欧洲体外诊断(IVD)医疗器械CE标志
Publisher: Administrator Date:2022-07-12
在欧洲销售的所有体外诊断试剂(IVD)器械都需要CE标记。CE标记意味着IVD器械符合欧洲体外诊断器械指令(IVDD 98/79/EC),并且该器械可能在欧盟合法上市。欧洲新的体外诊断法规(IVDR)将于2022年强制实施,从而大大改变了IVD的监管要求。
根据IVDD指令,体外诊断器械在欧洲可分为四类:
根据新的IVDR,将有四个基于风险的分类:A、B、C和D。大多数自测试的IVD将属于C类,目前被列为自我声明的许多IVD将被归类为更高的风险。
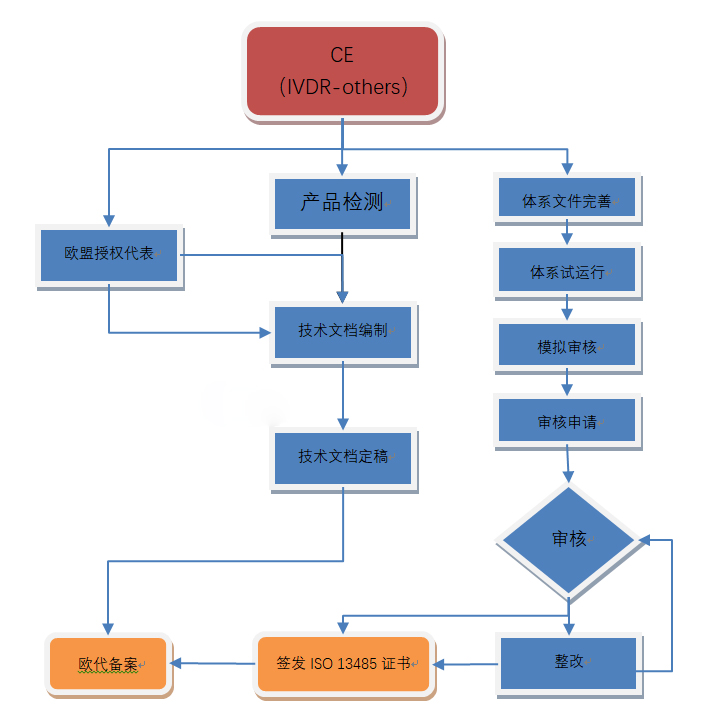
虽然IVD的CE认证过程与普通医疗器械类似,但是有一些关键的区别。下载我们的图表,解释IVD的CE标记过程。请注意,一旦欧洲执行新的体外诊断规则(IVDR),这一过程将发生重大变化。
1. 使用体外诊断指令(98/79/EC)确定器械的分类:一般IVD(自我声明),自测试IVD *,List B IVD(附录二),附录A IVD(附件二)
2. 对于一般IVD(自我声明)类,QMS没有正式的要求。对于其他IVD分类,按照IVDD 98/79/EC附录IV或VII实施质量管理体系(QMS)。大多数公司应用ISO 13485标准来实现QMS合规性。
3. 编写技术文档(List A为设计文档),其中提供了有关器械的详细信息,并表明符合IVDD 98/79/EC附录I的基本要求。
4. 如果制造商在欧洲没有实际的场地,需要任命一位欧洲授权代表,代表制造商在欧盟境内进行相关的法规联络事宜。
5. 对于一般IVD(自我声明),不需要公告机构的审核。自我声明器械的制造商在自己的器械上加贴CE标志。
对于所有其他分类的器械,质量管理体系和技术文件必须由欧洲公告机构进行审核,以审核和评估医疗器械制造商的质量体系和产品。
6. 从公告机构处获得CE证书和ISO 13485证书。
7. 起草并签署符合性声明(DOC),声明所涉及的IVD器械符合的指令要求。
8. 在产品上(包括标签、说明书等)加贴CE标志,并投放欧洲市场。对部分欧洲[敏感词],可能需要在上市前在该国医疗器械主管当局处进行额外注册或备案。
9. 对于List A的器械(附录II),进行批量测试并将结果转发给公告机构。
10. 维持质量体系和CE证书的有效性。
体外诊断试剂注册流程: