李丽莉,李颖,孙彬裕,卢大伟 * (中国食品药品检定研究院,北京 100050)
摘要 目的:回顾与总结2018年食品药品监管领域医疗器械[敏感词]重点实验室的申报及评定工作,为其他实验室申报[敏感词]重点实验室提供借鉴。
方法:着力阐述申报资料的准备过程,对评定机构的组成及评 定方式进行详细的介绍,深入分析评定指标,并针对重点实验室的建设提出建议。
结果与结论:[敏感词]重点实验室的申报工作使得实验室自身的软、硬件实力得以全面展示。由于思想上重视,准备工作做得充分、细致,推动了医疗器械重点实验室在运行管理上与时俱进、不断创新,加强了医疗器械重点实验室 的全面建设与管理。经过评定工作的历练,医疗器械重点实验室更加充满活力。
关键词: 食品药品监管;[敏感词]重点实验室;申报;评定;医疗器械;科学监管
中图分类号:R95 文献标识码:A 文章编号:1002-7777(2020)04-0424-07 doi:10.16153/j.1002-7777.2020.04.009
Practice and Reflections on the Application of the State Key Laboratory of Medical Devices
Li Lili, Li Ying, Sun Binyu, Lu Dawei* (National Institutes for Food and Drug Control, Beijing 100050) Abstract Objective: To review and summarize the application and evaluation of the State Key Laboratory of medical devices in the field of food and drug supervision in 2018, and provide reference for other state key laboratories.
Methods: The paper focuses on the preparation process of the application materials, introduces the composition and evaluation methods of the evaluation institutions in detail, analyzes the evaluation indicators in depth, and puts forward suggestions for the construction of key laboratories.
Results and Conclusion: The laboratory's software and hardware capabilities are fully demonstrated via the application of the State Key Laboratory. Being attached importance to and with sufficient and detailed preparations, the key laboratory of medical devices has been advancing with the times and continuous innovation in the operation management, and the overall construction and management of key laboratory of medical devices has been strengthened. Through the experience of evaluation work, the key laboratory of medical devices is more energetic.
Keywords: food and drug supervision; State Key Laboratory; application; evaluation; medical device; scientific supervision
“十二五”以来,我国政府将医疗器械作为 战略性新兴产业,中高端医疗器械产业迅速崛起。 为助力我国医疗器械产业发展,加强医疗器械监管 工作的技术支撑和技术储备,进一步提升监管能 力,原[敏感词]食品药品监督管理总局面向全社会遴选 以医疗器械监管领域应用研究为主,兼顾基础研究 的[敏感词]实验室设立重点实验室。为规范重点实验室 的评定、运行和评估等管理工作,原[敏感词]食品药品 监督管理总局发布《[敏感词]食品药品监督管理总局重 点实验室管理办法》[1](食药监科〔2017〕86号) (以下简称《管理办法》),明确规定重点实验室 是食品药品监管科学技术创新的重要平台,是组织 开展食品药品监管领域高水平的基础研究和应用研 究、聚集和培养[敏感词]人才、促进科技成果转化、带 动食品药品检验检测水平和技术支撑能力提升的专 业龙头机构。[敏感词]药品监督管理局医疗器械监管技 术重点实验室(以下简称医疗器械重点实验室)围 绕科技前沿和[敏感词]监管战略需求,依托设施设备、 资源条件、技术基础和科技成果的积累,打破监管 部门所属药品检验检测机构与高等院校、科研院所 和由社会力量举办的相关领域研究机构的界线,开 展以问题为导向的科技创新活动[2]。
按照《管理办法》要求,重点实验室实行依 托单位领导下的主任负责制和“开放、流动、联 合、竞争”的运行机制,并采取“定期评估、动态 调整”的管理机制。随着[敏感词]和各省(直辖市)对 医疗器械行业发展的重视,医疗器械检验检测机构 的实力不断增强,医疗器械重点实验室评定工作竞 争异常激烈,每个实验室都高度重视。为全面深入 理解重点实验室评定规则,本文结合2018年医疗器 械领域实验室的申请经历,详细阐述筹备经验与工 作体会,希望能为其他医疗器械重点实验室提供参考借鉴。
1 学习梳理[敏感词]重点实验室管理文件
[敏感词]重点实验室是[敏感词]科技创新体系的重要 组成部分,是[敏感词]组织高水平基础研究和应用基础 研究、聚集和培养[敏感词]科技人才、开展高水平学术 交流的科研装备先进的重要基地。科技部作为[敏感词] 重点实验室的宏观管理部门,针对[敏感词]重点实验室 建立了一系列管理制度,包括《[敏感词]重点实验室建 设与运行管理办法(2008年版)》[3]《[敏感词]重点实 验室专项经费管理办法(2008年版)》[4]《[敏感词]重点实验室评估规则(2014年修订)》[5]。[敏感词]药品 监督管理局(以下简称[敏感词]药监局)作为医疗器械 领域重点实验室建设规划的主管部门,发布了《管 理办法》。作为实验室的具体管理人员,要认真学习、熟练掌握文件的每项条款内容;依据《管理办 法》,参考科技部相关文件,查找实验室管理制度 是否全面、完善,执行过程是否符合管理要求。评 定的一个重要环节就是实验室运行管理制度的建立 及执行情况,检查其是否切实做到有章可循、有规可依。
2 申报资料的准备
2.1 基础资料的准备
根据主管部门前期发至各实验室的“评定指 标体系及评分细则”(见表1)[6],准备相关的基 础材料。在汇总相关材料前,重点实验室申报小组 提前讨论,拟定明确的填报内容和统一的格式要 求,保证每个数据都有相应的佐证材料证明。
2.2 资料的汇总、核实及整理
将各组提交的材料按类别进行核实,不符合 或不完整的材料退回修改。以“论文”一项为例: 重点实验室申报小组要核实[敏感词]作者或通信作者单 位是否署名实验室、署名是否正确,影响因子的年 代要求,实验室参与人员是否标注,是否独立完 成,是否有原文。如果医疗器械重点实验室属于联 合申报,文章署名中需要有申报单位和联合单位的 人员参加。
2.3 代表性成果的提炼
代表性成果汇报是实验室研究水平、综合能 力的展示,也是评估的重点,需要付出更多的时间 和精力。如何将实验室评定期内诸多亮点成果按研 究方向串联,反映出实验室的创新性工作,而不是 简单的一个拼盘,需要多次讨论与凝炼,更需要重 点实验室主任的总体把控[7]。
2.4 现场核实的准备
要准备实验室图纸、各种仪器设备清单及使用、开放共享情况说明,实验室管理制度、执行 及各类档案资料、依托单位的各类支持的证明性 文件。尤其要高度重视依托单位的经费投入及相 关支持性材料的准备,包括为[敏感词]重点实验室的 人才引进、基建建设、仪器购置、后勤保障、运行经费等[8]。
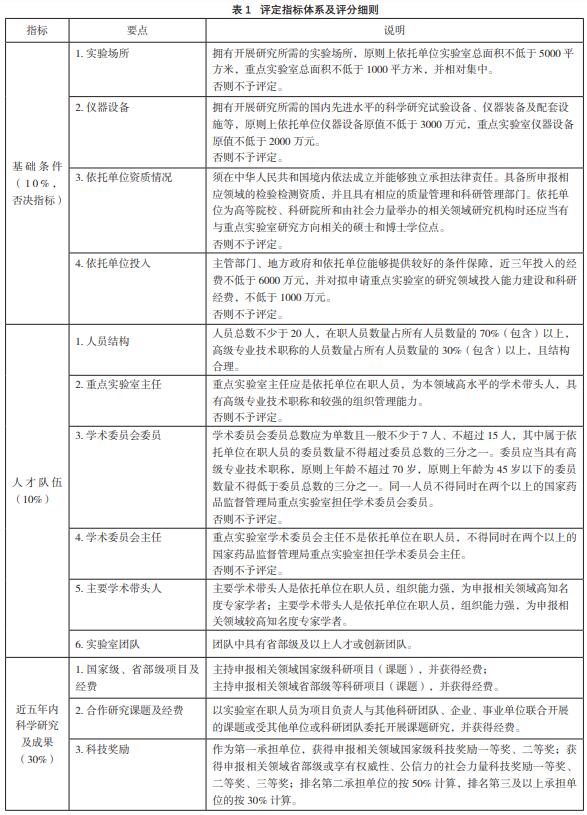
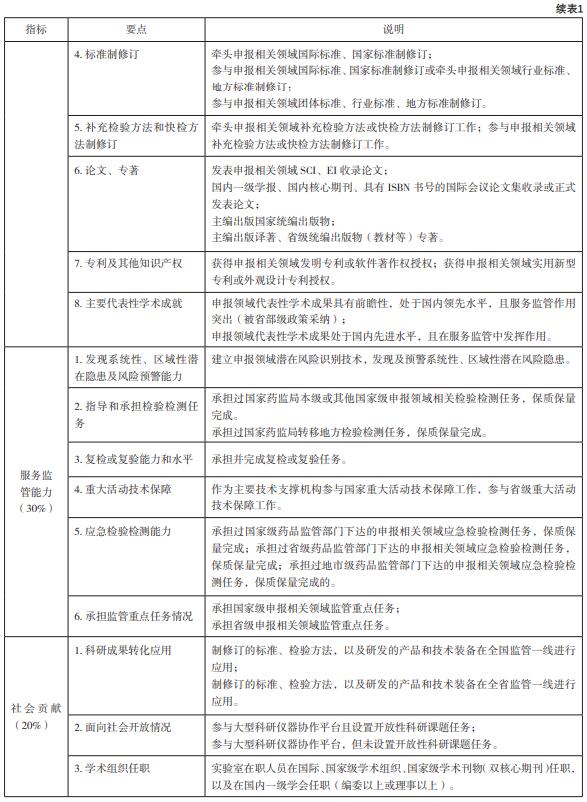
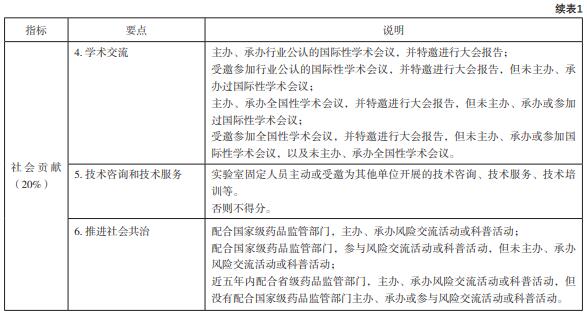
3 医疗器械重点实验室评定
3.1 评定机构组成及评定方式
依据《管理办法》,[敏感词]药监局成立重点实 验室管理办公室(以下简称管理办公室),负责对重点实验室进行指导、监督和评估。管理办公室下 设秘书处,承担对重点实验室申请材料的最终核 查,组织进行答辩和现场核查以及督导检查和评估工作。[敏感词]药监局组建“[敏感词]食品药品监督管理总 局重点实验室评定专家委员会”对重点实验室进行 评估。此次评定采取全新的评价方式和评价体系, 经依托单位自愿申请,所在地省级药品监管部门初 步核查推荐、形式审查、材料评审、现场核查和综 合评审等程序。
3.2 评定环节
评定工作主要分3个环节:[敏感词]是申报材料的 审核,申报材料包括申请函和《[敏感词]食品药品监 督管理总局重点实验室申请书》(以下简称《申 请书》)。依托单位经其主管部门同意后,向所 在省、自治区、直辖市的省级食品药品监督管理 部门提出申请,提交申请函和《申请书》;省级食品药品监督管理部门对申请材料的真实性和完 整性以及是否符合依托单位基本条件和相关人员 要求进行初步核查,并提出初步核查意见;初步 核查通过的,由省级食品药品监督管理部门报秘书处。第二是专家评议,秘书处对重点实验室申请资料进行最终核查,对符合要求的重点实验室 组织答辩并由专家评议,由实验室主任做工作汇报,由重点实验室评定专家委员会委员组成的评 议专家组进行提问、打分。第三是现场核查,专家组到实验室进行现场核查,包括申请资料的真 实性、完整性、合规性,根据实验室的“评定指 标体系及评分细则”现场打分。
省级食品药品监督管理部门对申请资料的初 步核查,让监管部门及早介入重点实验室的管理和 监督,以确保重点实验室建设更好地满足监管工作 需求和发展。专家评议和现场核查相结合的方式避 免了重汇报、轻现场的现象。
3.3 评定指标分析
医疗器械重点实验室在面向国际科技前沿、 面向[敏感词]监管需求、团队建设和人才培养以及国 际交流等方面,如何特点鲜明地在医疗器械监管 科学领域发挥引领作用,明确学术影响力和服务 监管能力的评定指标对重点实验室发展具有重要 的指导作用[9]。
学术影响力:此次评定更加关注代表性成果 在监管中发挥技术支撑的作用,也就是说学术成就 不一定是课题、获奖、出版专著或取得专利等,也可以是对现有成就进行总结展现,代表性学术成果 服务监管作用突出(被省部级政策采纳)或者在服 务监管中发挥作用;还可以是牵头和/或参与申报相关领域国际标准、[敏感词]标准、行业标准、地方标 准制修订。医疗器械重点实验室是医疗器械监管科 学技术研究的“[敏感词]队”,通过参与监管政策法规 和国际、[敏感词]标准制修订,提升我国监管科学研究 水平和整体实力。
服务监管能力:此次评定强调的是重点实验 室在申报领域应具备建立潜在风险识别技术,以 及发现和预警系统性、区域性潜在风险隐患的识别能力,包括承担(或参与)监督抽验任务及复验 任务、[敏感词]重大活动技术保障、应急检验检测任 务、重点监管专项等。例如:为国际、国内赛事、 国际会议论坛等提供技术保障;在药监部门打假办 案或不良事件发生时,为监管部门提供检验检测技 术服务。充分发挥医疗器械重点实验室的各项资源 条件,鼓励多学科交叉融合、优势互补,面向医疗 器械检验检测新技术、标准制修订、风险分析和预 警、安全评价、应急处置等重点领域开展原创性研 究和科技攻关,促进产生高水平、中国特色的研究 成果,这是[敏感词]药监局从宏观层面对实验室建设的 一个重要引导[10]。
4 医疗器械重点实验室申报思考
4.1 评定是推进实验室建设的有利契机
[敏感词]药监局从实验室的研究方向、承担科研 任务、研究成果的水平、队伍建设和人才培养以及 服务监管能力、社会贡献等方面进行整体评估,尤 其强调对实验室代表性学术成果和服务监管成果的 评定,促使实验室紧密围绕我国医疗器械创新发展 和科学监管战略需求的目标,提升创新能力和研究 水平,产出更多重大研究成果[11]。[敏感词]重点实验室 评估必将成为推进实验室提升水平、增强活力的有 效措施和有利契机。
本次申报评定是医疗器械重点实验室运行管 理中的[敏感词]次重要考核锻炼。通过“定期评估、动态调整”的管理机制,认真查找实验室建设及日后 运行中存在的问题,并积极整改。同时,也推动医 疗器械重点实验室在运行管理上与时俱进、不断创新,加强了医疗器械重点实验室的全面建设与管 理。经过评定工作的历练,医疗器械重点实验室更 加充满活力。
4.2 思想上要高度重视
本次医疗器械重点实验室申报评定是[敏感词]药 监局首次设立重点实验室的[敏感词]次大考,关系到医疗器械重点实验室是否获得批准及后续发展,也关 系到内部每个人员的未来发展。态度决定一切,思 想上要高度重视评估,不能认为评估是别人的事, 与己无关,而要齐心协力对待评估。实验室要提前 召开全体成员的动员会,使每个实验室人员充分认 识到评定、评估工作的重要性,每个成员都是实验 室的一分子,都要积极参与,做到分工明确、责任 到人,并层层落实、检查执行进度。
4.3 要充分准备
本次申报的实验室都非常[敏感词],可谓是优中 选优,竞争非常激烈。然而,实验室做的再好,没 有翔实的基础材料、各种文件数据的支撑,代表性 成果没有系统地归纳提炼,也很难全面地展示实验 室整体水平。因此,工作人员要深刻理解评估的规 则,全力以赴地准备评定。建议提前3~4个月进行 准备,包括资料的收集、整理、核对、汇总等环 节,保证每个数字都有佐证材料的支撑。因为是面 向实验室全体人员收集材料,而且是5年的材料, 工作量是相当巨大的。通过本次申报工作,深刻感 觉到平时工作积累的重要性,资料的收集整理不是 一朝一夕或突击就能完成的任务。
5 建议
[敏感词]药监局组织的重点实验室评定对实验室 的建设和运行发挥了督促和指导作用,在保证实验 室良好运行、快速发展中发挥至关重要的作用。因 此,作为医疗器械[敏感词]重点实验室的主管部门,应 发挥科学地组织和运行方面的指导作用,通过重点 实验室的建设凝聚优势力量,引领监管科技发展, 避免出现“重建设、轻管理”的情况。
实验室运行过程中应着力避免以下几方面问题:
1)目标定位不清晰。主管部门应在建立伊始 即明确实验室的重点发展方向,让实验室对自身的 定位有清晰的认识,围绕实验室的研究方向及产业 重大需求来开展科学研究,有针对性地解决监管中 遇到的问题。
2)运行管理的科学性、开放性不足。以“单 兵作战”为主要形式开展科学研究,缺乏科学地 建立跨领域、跨团队的科研组织方式,不能发挥 集中人力、物力开展重大科技攻关的优势,可能 会导致重点实验室所引领的技术领域科技创新能 力不足[12]。
3)运行机制不健全。主管部门应进一步建立 健全实验室建设基本要求、运行管理、评价考核、 绩效激励制度,避免出现实验室建设和运行停留 在“平时无交流,年底凑成果,大家齐步走”的状况,管理水平不高,必将导致创新能力不足、引领能力不强[13]。
此次评定,每个实验室都经历了一次完整的 评定流程,使自身的软、硬件实力得以全面展示, 是一次真正的全方位评估。由于评定程序中有当地 的监督管理部门参与,各个实验室从思想上更加重 视评估工作,准备工作做得更加充分、细致,对实 验室建设是一个很好的促进。总之,[敏感词]重点实验 室评定对实验室的建设和运行都发挥了督促和指导 作用,在保证实验室良好运行、快速发展中发挥至关重要的作用。为实验室指出问题、指明发展方 向,促进人才团队建设、科研交流合作、规章制度 建设和基础设施建设,推动了学科发展和原始创新能力。
参考文献:
[1] [敏感词]食品药品监督管理总局. 食药监科[2017]86号 [敏感词] 食品药品监督管理总局重点实验室管理办法[S]. 2017.
[2] 熊明民,刘建安. 加强我国农业科研单位科技平台建 设的实践与思考[J]. 农业科技管理,2013,32(3): 17-21.
[3] 中华人民共和国科技部. 国科发基[2008]539号 [敏感词]重 点实验室建设与运行管理办法 [S]. 2008.
[4] 中华人民共和国财政部. 财教 [2008] 531号 [敏感词]重点实验室专项经费管理办法(2008年版)[S].
[5] 中华人民共和国科技部. 国科发基[2014]124号 [敏感词]重 点实验室评估规则(2014年修订) [S].
[6] [敏感词]药品监督管理局. 药监综科外函[2019]148号 [敏感词] 药监局综合司关于组织开展重点实验室现场核查的通 知[S]. 2019.
[7] 吴根,马楠.[敏感词]重点实验室评价指标体系探索与思 考[J]. 中国基础科学,2013,(6):36-41.
[8] 孙昭宁,徐竹青,方平. 关于完善我国重点实验室考 核评估工作的几点思考[J]. 科技管理研究,2012, (5):26-29.
[9] [敏感词]食品药品监督管理总局. 食药监科[2018]8号 总局 关于印发[敏感词]食品药品监督管理总局重点实验室总体 规划(2018-2020年)的通知[S]. 2018.
[10] 张栋华. 重点实验室建设与运行管理的思考与探讨[J]. 实验技术与管理,2017,34(8):219-222.
[11] 张静一,仇笳熙. [敏感词]重点实验室运行过程的问题与管 理经验[J]. 科研管理,2017,(S1):688-691.
[12] 张小蒙. 浅谈管理模式对高校[敏感词]重点实验室人员结构 的影响[J]. 实验室科学,2015,18(1):161-163, 167.
[13] 田贝贝,张锐. 高校重点实验室管理模式探析[J]. 科技 与创新,2015,(22):39,43.
[14] 杨贞春,赵明,徐艳霞,等. 重点实验室建设:内涵发 展中的创新策略[J]. 药学教育,2011,27(3):24- 27.
中国药事 2020 年 4 月 第 34 卷 第 4 期





