01、什么是医疗器械
什么是医疗器械呢?
简单粗暴的说法:医院里,除了人和药,都是医疗器械。
比如医生给你看嗓子用的压舌板,抽血化验的试剂盒;血压计、血糖仪;病床、手术床;拍胸片的X光机等等,都是医疗器械。
(提示:我们经常说的生物医药产业,包括政策制订、数据测算等,都含有医疗器械。但从国民经济行业分类代码来看,医疗设备包含于通用设备内,体现了其制造业属性。)
我们需要学习定义么?是不是有点咬文嚼字呢?并不是。

举例以下三个问题:
1. 给宠物治疗用的设备,算“医疗器械”么?
在我国,医疗器械是给人用的;给动物用的器械,不在[敏感词]药监局监管的医疗器械范围内。而在美国,动物用医疗器械也属于FDA监管范围。
2. 康复用器械,算“医疗器械”么?
事实上,“康复辅助器具”和“医疗器械”是两个概念。
前者定义为“康复辅助器具,亦称康复辅具,是指预防残疾,改善、补偿、替代人体功能和辅助性治疗的产品,包括器具、设备、仪器、技术和软件。”
康复用器械,只有一部分矫形器和一些个人医疗辅助器具,属于医疗器械。大部分都纳入康复辅具,由民政部监督管理。
3. 口罩、纱布、隐形眼镜……算医疗器械么?
隐形眼镜、体温计、医用脱脂棉、医用脱脂纱布、医用卫生口罩、避孕套、轮椅等,都属于医疗器械。均在监管范围内。
(其他不再一一列举。)
不同的[敏感词],医疗器械都有相应的监管部门和定义,范围是不大一样的。
02、中国的医疗器械定义
中国的医疗器械监管部门:
[敏感词]食品药品监督管理局
(文中经常提到的[敏感词]局、[敏感词]药监局,NMPA)
官方网站:https://www.nmpa.gov.cn/
医疗器械定义:
医疗器械,是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是:
(一)疾病的诊断、预防、监护、治疗或者缓解;
(二)损伤的诊断、监护、治疗、缓解或者功能补偿;
(三)生理结构或者生理过程的检验、替代、调节或者支持;
(四)生命的支持或者维持;
(五)妊娠控制;
(六)通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
(来自《医疗器械监督管理条例》(中华人民共和国国务院令第739号)附则)
03、中国医疗器械分类
一、分类依据相关的政策文件
《医疗器械监督管理条例》(2020年12月21日国务院第119次常务会议修订通过)
《医疗器械分类规则》([敏感词]食品药品监督管理总局令第15号)
《体外诊断试剂分类规则》([敏感词]食品药品监督管理总局2021年第129号)
关于发布医疗器械分类目录动态调整工作程序的公告([敏感词]食品药品监督管理总局2021年第60号)
二、“依据影响医疗器械风险程度的因素,医疗器械可以分为以下几种情形:
(一)根据结构特征的不同,分为无源医疗器械和有源医疗器械。
(二)根据是否接触人体,分为接触人体器械和非接触人体器械。
(三)根据不同的结构特征和是否接触人体,医疗器械的使用形式包括:
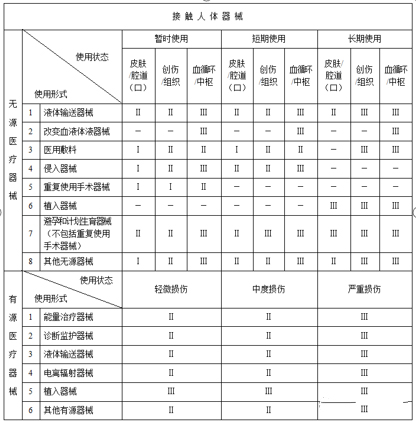
无源接触人体器械:液体输送器械、改变血液体液器械、医用敷料、侵入器械、重复使用手术器械、植入器械、避孕和计划生育器械、其他无源接触人体器械。
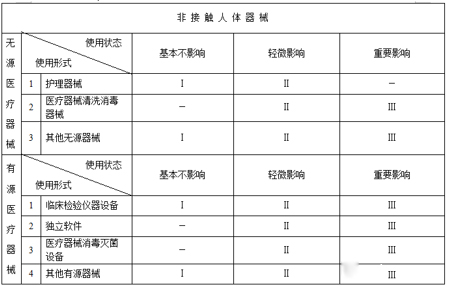
无源非接触人体器械:护理器械、医疗器械清洗消毒器械、其他无源非接触人体器械。
有源接触人体器械:能量治疗器械、诊断监护器械、液体输送器械、电离辐射器械、植入器械、其他有源接触人体器械。
有源非接触人体器械:临床检验仪器设备、独立软件、医疗器械消毒灭菌设备、其他有源非接触人体器械。”
(四)根据不同的结构特征、是否接触人体以及使用形式,医疗器械的使用状态或者其产生的影响包括以下情形:
无源接触人体器械:根据使用时限分为暂时使用、短期使用、长期使用;接触人体的部位分为皮肤或腔道(口)、创伤或组织、血液循环系统或中枢神经系统。
无源非接触人体器械:根据对医疗效果的影响程度分为基本不影响、轻微影响、重要影响。
有源接触人体器械:根据失控后可能造成的损伤程度分为轻微损伤、中度损伤、严重损伤。
有源非接触人体器械:根据对医疗效果的影响程度分为基本不影响、轻微影响、重要影响。”
(名词解释:
无源医疗器械:不依靠电能或者其他能源,但是可以通过由人体或者重力产生的能量,发挥其功能的医疗器械。
有源医疗器械:任何依靠电能或者其他能源,而不是直接由人体或者重力产生的能量,发挥其功能的医疗器械。
独立软件:具有一个或者多个医疗目的,无需医疗器械硬件即可完成自身预期目的,运行于通用计算平台的软件。这一类也是医疗器械)
三、按《医疗器械分类规则》([敏感词]食品药品监督管理总局令第15号)中的大类
01 有源手术器械
02 无源手术器械
03 神经和心血管手术器械
04 骨科手术器械
05 放射治疗器械
06 医用成像器械
07 医用诊察和监护器械
08 呼吸、麻醉和急救器械
09 物理治疗器械
10 输血、透析和体外循环器械
11 医疗器械消毒灭菌器械
12 有源植入器械
13 无源植入器械
14 注输、护理和防护器械
15 患者承载器械
16 眼科器械
17 口腔科器械
18 妇产科、辅助生殖和避孕器械
19 医用康复器械
20 中医器械
21 医用软件
22 临床检验器械
四、按监管的风险分类
内容详情见《医疗器械监督管理条例》国令第739号。其中对医疗器械注册与备案、生产、经营与使用、召回、监督检查进行了规定。
1. [敏感词]类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。如:外科用手术器械(刀、剪、钳、镊、钩)、刮痧板、医用X光胶片、手术衣、手术帽、检查手套、纱布、绷带、引流袋等。
[敏感词]类需向地市药监局提交备案资料。
备案依据《[敏感词]类医疗器械产品目录》
2. 第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。如医用缝合针、血压计、体温计、心电图机、脑电图机、显微镜、针灸针、生化分析系统、助听器、超声消毒设备、不可吸收缝合线等。
第二类需向省级药监局提交注册申请。
3. 第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。植入式心脏起搏器、角膜接触镜、人工晶体、超声肿瘤聚焦刀、血液透析装置、植入器材、血管支架、综合麻醉机、齿科植入材料、医用可吸收缝合线、血管内导管等。
第三类需向[敏感词]药监局提交注册申请。
补充的分类原则:
(一)如果同一医疗器械适用两个或者两个以上的分类,应当采取其中风险程度[敏感词]的分类;由多个医疗器械组成的医疗器械包,其分类应当与包内风险程度[敏感词]的医疗器械一致。
(二)可作为附件的医疗器械,其分类应当综合考虑该附件对配套主体医疗器械安全性、有效性的影响;如果附件对配套主体医疗器械有重要影响,附件的分类应不低于配套主体医疗器械的分类。
(三)监控或者影响医疗器械主要功能的医疗器械,其分类应当与被监控、影响的医疗器械的分类一致。
(四)以医疗器械作用为主的药械组合产品,按照第三类医疗器械管理。
(五)可被人体吸收的医疗器械,按照第三类医疗器械管理。
(六)对医疗效果有重要影响的有源接触人体器械,按照第三类医疗器械管理。
(七)医用敷料如果有以下情形,按照第三类医疗器械管理,包括:预期具有防组织或器官粘连功能,作为人工皮肤,接触真皮深层或其以下组织受损的创面,用于慢性创面,或者可被人体全部或部分吸收的。
04、市场视角的医疗器械分类
一、按临床科室分类
如:IVD、影像、心血管、骨科、普外科、眼科、神经外科等。
二、按产品形态和属性分类
1. 高值医用耗材(血管介入、电生理、骨科、眼科、口腔科、神经外科、其他介入类);、
2. 低值医用耗材(医用卫生材料及敷料、注射穿刺类、医用高分子材料类、医用消毒类、麻醉耗材类、手术室耗材类、医技耗材类)
3. 医疗设备
(1)诊断设备、治疗设备、生命支持设备、医用监视器/监护仪;
(2)医学实验室检测设备;
(3)家用医疗设备,等
4.IVD体外诊断
05国外医疗器械定义与分类
对于医疗器械企业来说,我们最常接触的是监管风险的分类,即常说的一类、二类、三类。因为这是我们产品上市必经的一环。从风险分类上,美国、欧盟、日本,跟中国类似。
一、美国医疗器械
美国的医疗器械监管部门:
U.S. Food&Drug Administration,美国食品药品监督管理局,简称FDA。
官方网站:https://www.fda.gov/
医疗器械(Medical Device)定义:
根据《食品、药品和化妆品法》第201(h)节,医疗器械为:
仪器、设备、器具、机器、用具、植入物、体外试剂或校准器,或者其他相似或相关物品,包含零部件或配件,它是∶
记载于正式的[敏感词]处方集,或美国药典,或其附录;
疾病的诊断、监护、缓解、治疗或预防,作用于人类或其他动物;
影响人体或其它动物身体的结构或功能,并且不是通过在人体或动物体内的化学作用,也不是依靠产生代谢变化来获得既定预期用途。
英文原文:
Per Section 201(h) of the Food, Drug, and Cosmetic Act, a device is:
An instrument, apparatus, implement, machine, contrivance, implant, in vitro reagent, or other similar or related article, including a component part, or accessory which is:
recognized in the official National Formulary, or the United States Pharmacopoeia, or any supplement to them,
intended for use in the diagnosis of disease or other conditions, or in the cure, mitigation, treatment, or prevention of disease, in man or other animals, or
intended to affect the structure or any function of the body of man or other animals, and which does not achieve its primary intended purposes through chemical action within or on the body of man or other animals and which is not dependent upon being metabolized for the achievement of its primary intended purposes.
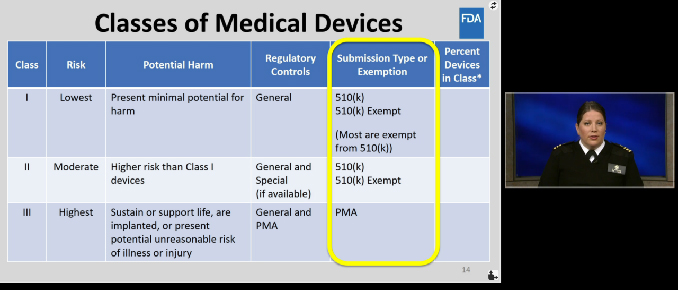
美国医疗器械分类
在美国, 医疗器械(Medical Device)分为I类、II类、III类,其中I类风险[敏感词]。
关于医疗器械产品选择什么分类,如何注册,FDA(美国食品药品监督管理局)官方有视频教程,在CDRH Learn中,链接:
https://www.fda.gov/training-and-continuing-education/cdrh-learn
对于大家常听说的510k,亦有详细说明。
二、欧盟的医疗器械
在欧盟销售的医疗器械产品需要有CE认证(CONFORMITE EUROPEENNE)。其相关的法规和定义在欧盟委员会网站上有。
官方网站:https://ec.europa.eu/
欧盟对于医疗器械、IVD、药械组合产品有不同的法规。医疗器械(Medical Devices,主要是设备)为Regulation (EU) 2017/745) ;IVD为In-Vitro Diagnostic Devices (Regulation (EU) 2017/746) 。以下是医疗器械部分。
医疗器械(Medical Device)定义:
“医疗器械”是指制造商打算单独或组合用于人类用于以下一个或多个特定医疗目的的任何仪器、器具、器具、软件、植入物、试剂、材料或其他物品:
—疾病的诊断、预防、监测、预测、预后、治疗或缓解,
—诊断、监测、治疗、减轻或赔偿伤害或残疾,
—检查,替换或修改解剖结构或生理或病理过程或状态,
—通过体外检查来自人体的标本提供信息,包括器官,血液和组织捐赠,
并且不能通过药理学、免疫学或代谢手段在人体内或上实现其主要预期作用,但可以通过这种手段辅助其功能。
以下产品也应被视为医疗器械:
—用于控制或支持受孕的设备;
—专门用于清洁、消毒或灭菌第1条第(4)款所述装置以及本条[敏感词]款所述器具的产品。
“医疗器械附件”是指其制造商打算与一种或几种特定医疗器械一起使用的物品,其本身虽然不是医疗器械,但其目的是使其能够根据其预期用途使用,或根据其预期目的具体和直接地协助医疗器械的医疗功能;
英文原文:
‘medical device’ means any instrument, apparatus, appliance, software, implant, reagent, material or other article intended by the manufacturer to be used, alone or in combination, for human beings for one or more of the following specific medical purposes:
—diagnosis, prevention, monitoring, prediction, prognosis, treatment or alleviation of disease,
—diagnosis, monitoring, treatment, alleviation of, or compensation for, an injury or disability,
—investigation, replacement or modification of the anatomy or of a physiological or pathological process or state,
—providing information by means of in vitro examination of specimens derived from the human body, including organ, blood and tissue donations,and which does not achieve its principal intended action by pharmacological, immunological or metabolic means, in or on the human body, but which may be assisted in its function by such means.
The following products shall also be deemed to be medical devices:
—devices for the control or support of conception;
—products specifically intended for the cleaning, disinfection or sterilisation of devices as referred to in Article 1(4) and of those referred to in the first paragraph of this point.
(2)‘accessory for a medical device’ means an article which, whilst not being itself a medical device, is intended by its manufacturer to be used together with one or several particular medical device(s) to specifically enable the medical device(s) to be used in accordance with its/their intended purpose(s) or to specifically and directly assist the medical functionality of the medical device(s) in terms of its/their intended purpose(s)。
欧盟医疗器械分类:
医疗器械分为 I类、IIa类、IIb类、III类,其中 I类风险[敏感词]
在欧盟申请CE认证,器械厂商可以阅读此说明
https://ec.europa.eu/growth/single-market/ce-marking/manufacturers_en
系列文件所在网页:
https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX:02017R0745-20170505
三、日本的医疗器械
日本负责监管器械的是厚生劳动省,该部门是负责日本医疗卫生和社会保障的主要部门,设有11个局7个部门,主要负责日本的国民健康、医疗保险、医疗服务提供、药品和食品安全、社会保险和社会保障、劳动就业、弱势群体社会救助等职责。
具体负责的是PMDA(Pharmaceuticals and Medical Devices Agency)
PMDA是厚生省医药食品局所管辖的独立行政法人,成立于2004年。
PMDA的业务主要包括审查、安全对策、健康损害救济三大板块。
在日本,医疗器械分为 I类、II类、III类、IV类,其中I类风险[敏感词]。
关于日本医疗器械相关内容,均可以在以下官方网站查询