美国医疗器械上市前通告制度的演变及启示
Publisher: Administrator Date:2022-08-04
摘要:美国是最早立法管理医疗器械的[敏感词],其监管模式的科学性和系统性已被世界上大多数[敏感词]和地区认可。本文以美国上市前通告制度为切入点,介绍各项法规的制修订对上市前通告制度带来的变革, 以及种种变革对企业注册申请情况的影响,希望能够为我国医疗器械的监管提供启示。
关键词: 医疗器械;上市前通告;历史演变;启示

医疗器械作为现代科学技术产品,从简单的
必不可少的压舌板、轮椅等到复杂的高科技产品,
如心脏起搏器、核磁共振成像仪等,被广泛用于疾
病的预防、诊断、治疗和康复,是现代医学领域中
重要的检查、治疗手段。我国在医疗器械监管方面
起步较晚,各项制度不尽完善,在保障公众用械安
全和鼓励创新研发方面还有较大进步空间。2017年
10月,中共中央办公厅、国务院办公厅印发了《关
于深化审评审批制度改革鼓励药品医疗器械创新的
意见》,我国的医疗器械监管迎来了新的机遇和挑
战。本文通过对美国FDA医疗器械上市前通告制度
变化的介绍和上述变化对上市注册的影响分析,希望对我国医疗器械监管提供借鉴。
1 概述
1.1 美国FDA医疗器械监管情况介绍
美国是国际上最早从法律上对“医疗器械”
(Medical Device)作出定义的[敏感词][1],对医疗器械
的立法监管至今已有100多年的历史。为了确保医
疗器械的安全性和有效性,[敏感词]个对医疗器械实行
分类管理的也是美国[1]。美国FDA根据风险等级、
上市前安全性和有效性的评估需求,将医疗器械分
成Ⅰ、Ⅱ、Ⅲ类以进行上市前管理[2-5]。
美国FDA对医疗器械的上市前准入制度分两种:上市前通告[Premarket Notification,俗称510(K)]和上市前审批申请(Premarket Approval
Application,PMA)[6-7]。大多数Ⅰ类产品为低
风险或无风险的产品,仅需要进行“普通管理
(General Controls)”,如听诊器、压舌板等。
FDA对此类产品豁免上市前通告程序,生产企业
向FDA提交材料证明产品符合医疗器生产质量管
理规范并进行登记后即可上市销售。Ⅱ类产品,
如计算机断层(CT)扫描器等,在实行“普通管
理”基础上还要进行诸如附加标签要求等“特殊
管理(Special Controls)”。除部分Ⅱ类产品豁
免上市前通告外,多数需要进行上市前通告,即
市场预投放登记。Ⅲ类产品一般具有较高风险或
危害性,或者属于维持生命的产品,如人工心脏
瓣膜、心脏起搏器、人工晶体等。此类产品上市
前需要进行临床研究,评估器械的安全性和有效
性,即“上市前批准管理(Premarket Approval,
PMA)”申请[8]。
1.2 上市前通告简介
上市前通告是根据《联邦食品、药品和化妆
品法》第510节第k条规定,生产企业[敏感词]次在美国
市场销售产品,或已上市但有重大改变的产品在上
市前应向FDA呈报相关信息,阐明拟上市产品与已
上市的参照器械(Predicate Device)在安全性和有
效性上是否实质等同[9-10]。
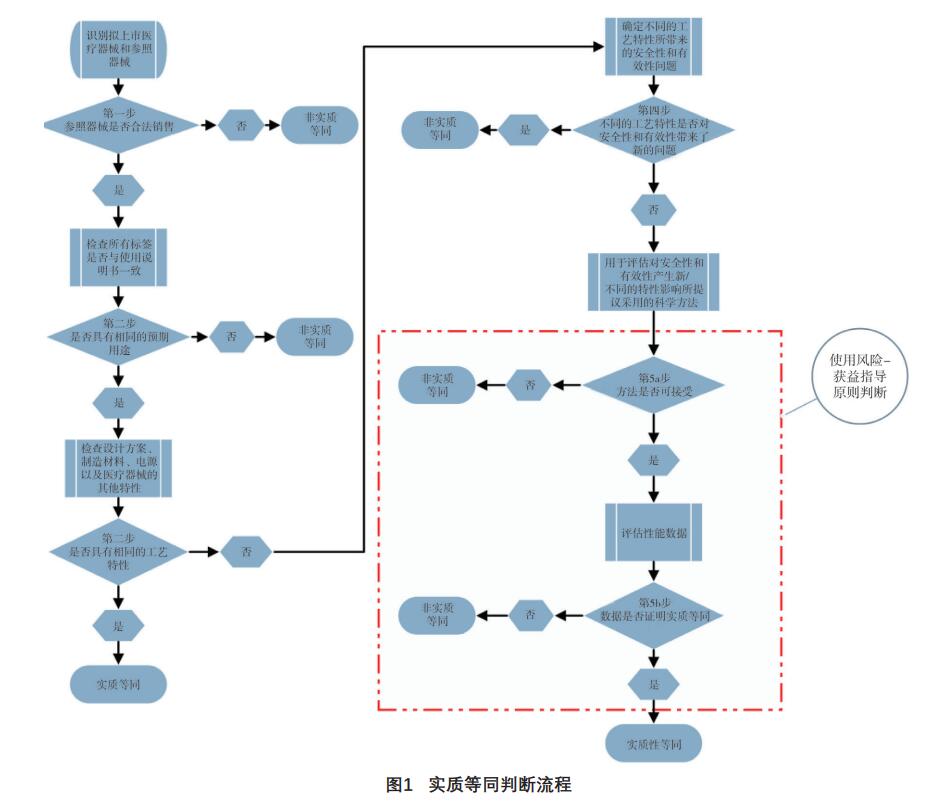
实质等同(Substantial Equivalence,SE)并非
指原材料、制造工艺完全一样,而是指:1)拟上
市医疗器械与参照器械具有相同的预期用途和相同
的技术特征;2)拟上市医疗器械与参照器械具有相同的预期用途,虽不具有相同的技术特征,但不
会引起安全性和有效性上的新问题[11]。开展实质等
同的判断时,判断标准应宽严适度,判断过严会无
谓地增加企业负担、延缓新产品上市,但标准过松
则不能保证新产品的安全性和有效性。FDA开展实
质等同判断的流程见图1。
2 FDA上市前通告制度的历史演变
2.1 《医疗器械修正案》
1938年的《联邦食品、药物和化妆品法案》
(Federal Food,Drug and Cosmetic Act)是世界上
[敏感词]部医疗器械法规。但该法规仅对医疗器械的监
管作了简单规定,赋予FDA开展医疗器械监管的权
利,但该权利仅限于对假冒伪劣或虚假标签的产品
提起诉讼。1976年,美国国会通过的《医疗器械修
正案》(Medical Device Amendments)[12],加强了
医疗器械监督和管理的力度,确立了对医疗器械实
行分类管理,提出上市前通告和上市前审批的市场
准入制度,至此,FDA监管框架已形成。
2.2 《医疗器械安全法案》
1990年,美国国会通过了《医疗器械安全法
案》(Safe Medical Device Act)[12],相比于1976年
的《医疗器械修正案》增加了许多新内容:
(1)明确概念。《医疗器械安全法案》明确
“实质等同”的定义和判断标准,首次提出参照
器械(Predicate Device),使FDA的决策更具理论
依据。
(2)多元化标准。《医疗器械安全法案》中
提出“特殊标准”(Special Control)概念,指出对
产品安全有效性的判断依据除检验标准外,还应综
合考虑产品上市后表现、患者的使用意愿、对指导
原则的引用情况及其他FDA认为必要的因素,使得
技术审评判断标准更加灵活多样。
(3)增加上市后监督。《医疗器械安全法
案》新增第522节,FDA有权对用于婴幼儿或植入
人体等特殊医疗器械开展上市后监督,监督方式有
多种,不仅包括生产企业和监督部门的监督,还包
括对不良事件的评估分析、召回事件和其他政府机
构的报告。
2.3 《食品和药品管理局现代化法》
1997年,美国国会通过的《食品和药品管
理局现代化法》(Food and Drug Administration
Modernization Act)授权FDA为加速审评进行大范
围的改革,包括豁免Ⅰ类和部分Ⅱ类产品的上市前
通告、允许第三方机构开展上市前通告审评、对创
新产品提出重新分类(De Novo)程序,并提出最小负担原则,用于指导上述改革。
(1)豁免上市前通告
FDA规定对全部Ⅰ类和部分Ⅱ类产品豁免上市
前通告,只需向FDA提交材料证明产品符合安全、
有效性要求,并进行登记后即可上市销售。FDA判
断Ⅱ类产品是否能豁免时一般考虑产品上市后有无
严重的医疗事件、产品设计能否有效避免伤害(比
如通过观察或使用前检测可有效避免伤害)、产品
的各类变更引起类别调整的可能性等等。
(2)引入第三方机构
为加速审评,FDA允许第三方机构对特定的Ⅱ
类产品进行初审,再由FDA根据初审意见作出最终
决定。
(3)重新分类程序 [13-15]
以往,一个产品获得非实质性等同(NSE)的
结果后将被自动归入Ⅲ类,要求通过临床试验提供
安全、有效性证据,但对于安全风险不高的创新产
品无疑会增加生产企业负担,延缓产品上市。为
此,FDA提出重新分类程序,NSE的创新产品可提
出重新分类程序,由FDA进行归类,归类成功后无
需提交上市申请即可直接上市销售。
(4)最小负担原则
《食品和药品管理局现代化法》提出最小负
担原则(Least Burdensome),要求FDA尽可能地
减轻申请人负担,向申请人提出的申报资料要求必
须出于对产品安全、有效性的验证目的[15]。
2.4 《医疗器械用户收费和现代化法》
2002年通过的《医疗器械用户收费和现代化
法》(Medical Device User Fee and Modernization
Act)修正了《联邦食品、药品和化妆品法》,对
上市前通告制度而言[敏感词]的变化是向用户收费,
且之后的每5年修订《医疗器械用户收费和现代化
法》,对收费标准进行调整。
3 上市前通告制度变化对美国注册审评的影响分析
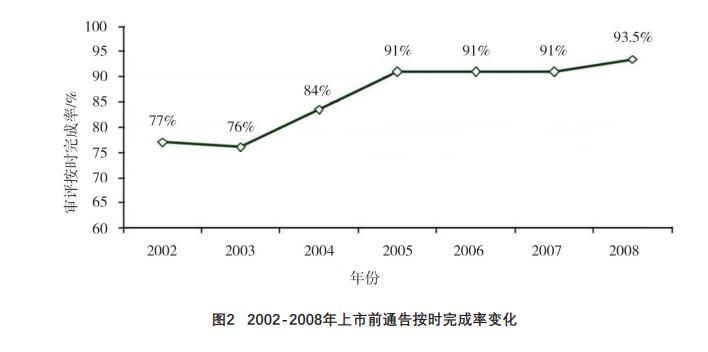
3.1 对审评时长的影响
FDA对外公布的数据显示[16],自2002年开始向
审评用户收费起,上市前通告的审评按时完成率[17]
从77%提高到了2008年的93.5%,详见图2。
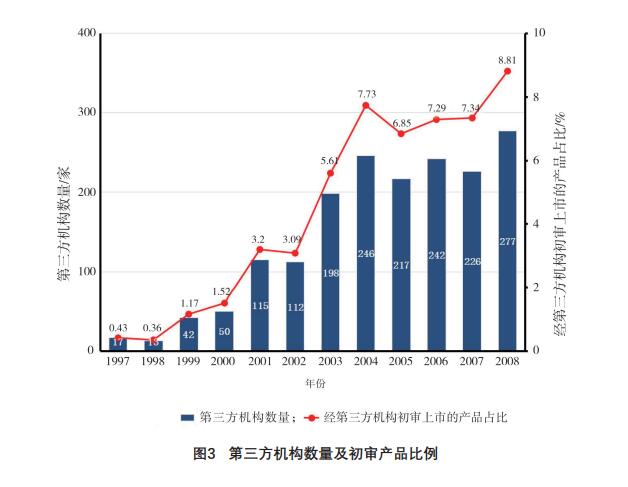
3.2 第三方机构的审评项目占比
笔者对FDA已公布的上市前通告产品进行分
析,发现自1997年美国国会通过《食品和药品管理
局现代化法》允许第三方机构开展上市前通告的初审工作后,经第三方机构初审获准上市的医疗器械
产品占比不断提高,第三方机构数量亦有显著增
加,具体见图3。
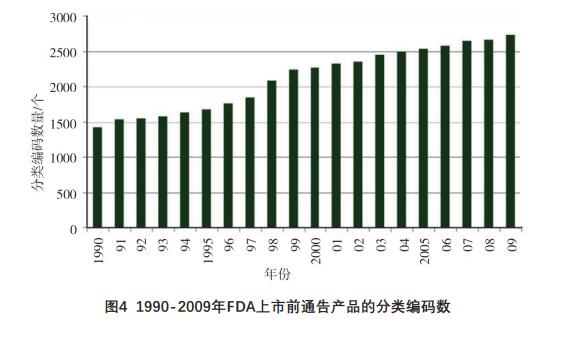
3.3 医疗器械分类编码数量
FDA为便于管理,将医疗器械产品按照用途分
类,并赋予分类编码,分类编码的增加间接反映新
医疗器械产品的注册多寡。根据FDA公布数据[16],自1990年起,每年的分类编码数量稳中有升,截至
2009年底,上市前通告产品的分类编码数量超过
了2500个,反映了FDA鼓励创新的各项措施效果显
著,详见图4。
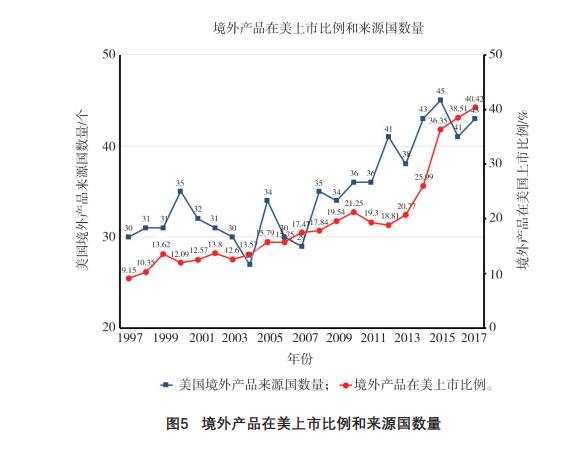
3.4 注册国数量
监管部门的各项制度可直接影响境外生产企业的注册申报数量,笔者通过观察1997-2017年经上市前通告在美上市的境外产品比例和来源国数量,发现截至2017年在美上市的境外产品比例超过
了30%,共涉及43个[敏感词],FDA的监管环境获得了多国认可,详见图5。
4 对我国监管制度的启示
美国的医疗器械产业环境遇到了很多新的挑
战,如应对全球化、鼓励创新等[18-20],上述数据有
力地证明了FDA上市前通告制度变革不仅成功应对
了挑战,而且吸引世界各国的生产和研发企业赴美
注册上市。对我国监管机构的启示:
4.1 加快立法,理顺各方关系
FDA上市前通告的各项变革均通过立法开始,
这一出发点保证了监管部门在开展上市前通告时真
正做到有法可依。反观我国,《医疗器械监督管理
条例》法律地位低[21-23],因此,加强医疗器械监管
工作,首要任务是提高法律地位,加快立法工作,建议出台《医疗器械监督管理办法》,明确[敏感词]、
省、市各方职责及与其他部委间的职责分工,理顺各方关系。
4.2 提升监管理念,构建监管科学
美国FDA公布的监管战略是“推进监管科学
的发展与创新”,为实现战略目标提出了风险-获
益理念[24-25]和最小负担原则理念,并以上述理念为
指导制定了各项制度和指导原则。这种“战略-理
念-实现途径”指导下的监管方式,目的性更强,
监管更加科学严谨。建议我国监管机构借鉴FDA的
制度建立模式,改变现有“问题-制度”模式,从更为宏观的角度制定战略,并为战略的实现出台系
列规定,使各项制度环环相扣,逐步建立符合中国国情、行业特色的监管科学。
4.3 重视队伍建设,提升智力支持
建立一支业务过硬的队伍是保证审评工作的
前提,也是加快审评的基础。FDA通过注册申请收
费制度为聘用更多的审评人员和改善软硬件条件提
供资金支持[26],同时,借助第三方机构的审评力量
加速审评。建议我国加强审评队伍建设,进一步
增加审评人员数量,根据监管专业特点,合理配
置岗位;对在岗审评人员制定培训规划、加大培训
力度;通过轮岗、借调、下派锻炼等方式加强地区
间、部门间的交流学习;建立合理的激励机制,用
制度规范人、激励人。条件允许的话,合理利用外
部资源,鼓励第三方机构开展初审业务,进一步加
速医疗器械审评审批。
4.4 转变监管模式,明确监管需求
FDA在监管过程中发布了一系列关于上市前通
告的指导原则,从参比器械的选择[27]、分类编码[28]
的制定到审评流程和判断标准等等,这些指导原
则事无巨细地对上市前通告中的各项程序和遇到的
情况进行罗列和说明,以此指导监管部门工作,减
少主观判断,使审评结论更加客观准确。同时,监
管需求的明确为产品研发和上市注册提供依据。因
此,明确的监管需求即是监管公开透明的体现,也
是最小负担理念的应用。建议我国监管机构进一步
重视对内部流程的规范、内部标准的细化,减少主观判断,加大制度公开力度,为审评结论更加客观
准确创造条件。
近年,我国医疗器械上市前监管水平得到了
很大提高,[敏感词]也通过政府购买服务的方式大力招聘审评员,为提高审评队伍数量和质量持续努
力。但审评的质量和流程的规范性较美国仍存在很
大差距[29-31],因此,我国监管机构应充分吸收发达[敏感词],尤其是美国FDA对于医疗器械监管的先进经
验,结合中国实际,建立适合国情的医疗器械监管体系,确保公众用械安全,提高公众健康水平。
参考文献:
[1] 陈以桢,高惠君. 美国、欧盟医疗器械法规概况及与我国法规的对比[J]. 中国医疗器械信息,2008,32
(3):218-226.
[2] US Food and Drug Administration.FDA and Industry
Procedures for Section 513(g)Requests for Information
under the Federal Food, Drug, and Cosmetic Act [EB/
OL].(2012-04-06)[2019-01-02]. http://www.fda.
gov/medicaldevices/deviceregulationandguidance/
guidancedocuments/ucm209841.htm.
[3] US Food and Drug Administration.User Fees for 513(g)
Requests for Information Guidance for Industry and Food
and Drug Administration Staff [EB/OL].(2017-10-
2)[2019-01-02]. http://www.fda.gov/medicaldevices/
deviceregulationandguidance/guidancedocuments/
ucm209852.htm.
[4] 卢爱丽,薛玲,孙京昇. 对美国医疗器械监管的研究[J].
首都医药,2008,(6):4-6.
[5] 屈宝刚. 美国医疗器械法规介绍[J]. 中国医疗器械信
息,2005,(1):29-30.
[6] 沈翀. 美国FDA医疗器械和放射健康中心(CDRH)
医疗器械监管模式概述[J]. 中国医疗设备,2010,25
(3):129-131.
[7] 张冬娟. 美国和欧盟的医疗器械监管[J]. 中国信息界(e
医疗),2012,(7):30-31.
[8] 常永亨. 美国对高风险医疗器械的审批[J]. 中国医疗器
械杂志,2013,37(2):132-136.
[9] 岳伟. 我国医疗器械注册制度与美国510K注册的比较
[J]. 中国医疗器械杂志,2009,3(1):51-58.
[10] 王兰明,王宿. 美国、欧盟医疗器械上市许可管理制度
及其启示[J]. 中国药业,2012,21(24):1-5.
[11] US Food and Drug Administration. The 510(k)
Program:Evaluating Substantial Equivalence in
Premarket Notifications [510(k)] [EB/OL].(2014-07-
28)[2019-01-02]. https://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/GuidanceDocuments/
UCM284443.
[12] 张世庆,邓洁,章金刚. 美国医疗器械监管模式概述
[J]. 中国医疗器械信息,2009,15(10):62-66+82.
[13] US Food and Drug Administration.De Novo Classification
Process(Evaluation of Automatic Class III Designation)
[EB/OL].(2017-10-30)[2019-01-02]. https://www.
fda.gov/MedicalDevices/DeviceRegulationandGuidance/
GuidanceDocuments/UCM080197.
[14] US Food and Drug Administration. Expedited Access
for Premarket Approval and De Novo Medical Devices
Intended for Unmet Medical Need for Life Threatening or
Irreversibly Debilitating Diseases or Conditions [EB/OL].
(2015-04-13)[2019-01-02]. https://www.fda.gov/
downloads/medicaldevices/deviceregulationandguidance/
guidancedocuments/ucm393978.pdf.
[15] US Food and Drug Administration.The Least Burdensome
Provisions of the FDA Modernization Act of 1997:Concept
and Principles;Final Guidance for FDA and Industry [EB/
OL].(2002-10-04)[2019-01-02]. http://www.fda.gov/
downloads/MedicalDevices/DeviceRegulationandGuidance/
GuidanceDocuments/ucm085999.pdf.
[16] US Food and Drug Administration.CDRH Preliminary
Internal Evaluations – Volume I:510(k)Working
Group Preliminary Report and Recommendations [EB/OL].
(2010-8)[2019-01-02]. http://www.fda.gov/downloads/
AboutFDA/CentersOffices/CDRH/CDRHReports/
UCM220784.pdf.
[17] US Food and Drug Administration.FDA and Industry Actions
on Premarket Notification(510(k))Submissions:
Effect on FDA Review Clock and Goals Guidance for
Industry and Food and Drug Administration Staff [EB/
OL].(2017-10-02)[2019-01-02]. http://www.fda.gov/
downloads/MedicalDevices/DeviceRegulationandGuidance/
GuidanceDocuments/UCM089738.pdf.
[18] 张长虹,秦晓刚,刘宇静,等. 对欧美[敏感词]医疗器械
管理模式的探讨与分析[J]. 中国医学装备,2006,11
(3):5-9.
[19] 董春华. 美国医疗器械立法嬗变及其动因[J]. 时代法
学,2011,9(5):101-108.
[20] 蒙志莹,蔡天智. 美国医疗器械产业发展现状及启示 [J]. 中国医疗器械信息,2008,(1):51-54.
[21] 潘广成. 借鉴美国FDA管理经验加快我国医疗器械立法
强化行政管理和监督[J]. 中国药业,1995,(9):12-13.
[22] 温雪君,岑铨华. 医疗器械管理过程中存在的问题[J].
医疗装备,2017,30(7):89-90.
[23] 刘学林,张娇娇,刘海燕. 我国在用医疗器械监管中存
在的问题及对策研究[J]. 中国管理信息化,2016,19
(24):187-188.
[24] US Food and Drug Administration.Benefit-Risk Factors to Consider
When Determining Substantial Equivalence in Premarket
Notifications (510(k)) with Different Technological Characteristics
Guidance for Industry and Food and Drug Administration
Staff [EB/OL].(2018-09-25)[2019-01-02]. https://www.
fda.gov/MedicalDevices/DeviceRegulationandGuidance/
GuidanceDocuments/UCM404773.
[25] 石莉,李非,程茂波,等. 美国FDA医疗器械受益–风
险评估时需要考虑的因素指南介绍[J]. 中国医疗器械
信息,2018,24(19):1-4+32.
[26] 卢爱丽. 美国FDA2012财年医疗器械注册新变化[J]. 中
国医疗器械信息,2011,17(10):24-25.
[27] US Food and Drug Administration.Alternate Approaches
t o D e m o n s t r a t i n g S u b s t a n t i a l E q u i v a l e n c e i n
Premarket Notifications [EB/OL].(1998-03-20)
[2019-01-02]. http://www.fda.gov/MedicalDevices/
DeviceRegulationandGuidance/GuidanceDocuments/
ucm080187.htm.
[28] US Food and Drug Administration.Medical Device
Classification Product Codes - Guidance for Industry and
Food and Drug Administration Staff [EB/OL].(2013-04-
11)[2019-01-02]. https://www.fda.gov/MedicalDevices/
DeviceRegulationandGuidance/GuidanceDocuments/
ucm285317.htm.
[29] 阮吉敏. 中美医疗器械监管的比较与分析[J]. 国际医药
卫生导报,2005,(7):98-105.
[30] 孙勤,严梁. 欧美医疗器械管理经验及对中国医疗器械
法规体系改革的启示[J]. 中国医疗器械杂志,2006,
30(1):43-52.
[31] 梁晓婷,池慧,杨国忠. 欧洲、美国、日本医疗器械
标准管理及对我国的启示[J]. 中国医疗器械信息,
2008,(8):37-52+64.
作者:塔娜,李思,李耀华 *
([敏感词]药品监督管理局医疗器械技术审评中心,北京 100081)








