摘要:从加强依法行政,保护公众健康,健全医药法律体系和促进医疗器械行业发展等角度对我国当前医疗器械监管立法的必要性进行了研究,分析和总结美国、欧盟和日本等[敏感词]和地区医疗器械监管领域的立法经验和立法形式,认为从立法的政治保障、现实基础、探索和国际经验等方面来看,我国当前开展对医疗器械监管立法的条件已经比较成熟,并且为我国《医疗器械管理法》的出台提出了立法原则和立法形式等方面的政策建议。
关键词:医疗器械;监管立法;必要性;可行性
0 引言
医疗器械安全不仅关乎人民群众的身体健康和合法权益,也影响社会整体的稳定和谐。近年来,我国医疗器械行业规模和质量快速提升,[敏感词]在行业监管政策和监管方式方面不断推进改革,体外诊断试剂、医学影像、智能手术机器人等重点领域取得新突破,实现高端医疗器械产品的进口替代,国际市场占有率逐年提升,行业转型升级加快推进。但同时也应看到,我国医疗器械行业整体“多、小、散、弱”的格局并未得到根本改善,与欧、美、日等传统医疗器械产业强国相比差距仍旧显。
限制我国医疗器械行业发展的原因是多方面和深层次的,医疗器械监管领域立法滞后无疑也是重要因素之一。我国在2000年1月颁布《医疗器械监督管理条例》,标志着医疗器械监管初步迈入法制化、规范化时代,其后在2014年和2020年先后经过两次重要修订,内容体系逐步完善,立法质量不断提升。此外,[敏感词]药品监督管理局(简称[敏感词]药监局)及其下属的医疗器械技术审评中心先后发布《医疗器械注册管理办法》等医疗器械监管部门规章14部,医疗器械技术指导原则345个,医疗器械监管的法律体系已初具规模。但是我国的《医疗器械管理法》始终没有出台,法律体系中仍缺少最重要的“基本法”。
1 对医疗器械监管立法的必要性探讨
1.1 立法加强医疗器械监督管理,保证各级医疗
器械监管部门的行政活动有法可依我国现阶段医疗器械监管形势总体良好,但严格监管仍不容松懈。[敏感词]药监局统计数据显示,近5年来,全国各级的药监部门和市场监管部门查处并公布医疗器械违法案件年均超过6 000件,涉事主体涵盖医疗器械生产企业、医药公司、各类医疗机构和零售药店、眼镜店等。2020年以来,由于国内新冠疫情形势严峻,导致对体外诊断试剂、医用口罩、医用防护服、棉签、纱布等医用耗材等需求大增,假冒伪劣的医疗器械案件呈现持续上升的趋势。我们认为,对我国当前医疗器械监管进行立法十分必要,立法加强医疗器械监督管理,保证各级医疗器械监督管理部门的行政活动有法可依。因此,应尽快建立覆盖医疗器械全生命周期(life cycle of medical device)的监管体系,以防范和控制在医疗器械研发、生产、经营和使用等环节的风险为监管重点,将[敏感词]对于医疗器械监管的指导方针、政策和既往行之有效的措施等上升为法律形式固定下来。明确医疗器械监管应当以人民健康为核心目标,将[敏感词]对于食品药品监管的“四个最严”的根本要求自觉应用于医疗器械监管领域。
1.2 立法保护和促进公众健康,惩治医疗器械违法行为
医疗器械的安全关乎公众生命健康,医疗器械不良事件危害不容忽视。[敏感词]药品监督管理局公布的数据显示,在2020年度[敏感词]药品不良反应监测中心收到的医疗器械不良事件报告536 055份,其中死亡病例报告218份,严重伤害病例报告32 874份,一次性使用输液器、静脉留置针、监护仪等产品成为医疗器械不良反应事件重灾区。为保护和促进公众健康,应当着力完善医疗器械警戒制度,加强对医疗器械安全事件预防和应对。此外,畅通技术和行政监管的沟通渠道,强化行业监管部门与司法机关办理医疗器械违法案件的沟通衔接,完善对医疗器械产品的全品种、全过程和全链条监管,采取多种监管措施,加大惩治处罚力度,真正把“四个最严”要求落到实处。
1.3 立法健全我国医药领域法律体系,实现监管内容和形式国际化
医药领域的法律法规普遍以规范相关主题的生产、经营、使用等行为,以保证产品质量为根本手段,以保护和促进公众健康为目标,并具备极强的技术特征。因此,各国医药领域的法律体系和内容越发趋同,呈现出国际化的趋势。经济全球化使得医药领域国际产品贸易和技术交流日益频繁,并推动医药产业标准和监管方式国际化,同时使得人用药品注册技术要求国际协调会议(International Council for Harmonization,ICH)等国际性的医药管理制度、技术协议、规范等的缔约[敏感词]也不断增加。对于药品监管,我国先后由全国人大常委会颁布了《药品管理法》《疫苗管理法》和《中华人民共和国中医药法》等多部法律,而对于医疗器械的监管仍主要依照《医疗器械监督管理条例》实施,其为国务院颁布的行政法规,法律效力层级不高。因此,建立我国的《医疗器械管理法》是健全我国医药领域法律体系,补齐医疗器械监管短板的必然选择。
1.4 立法促进我国医疗器械行业健康持续发展
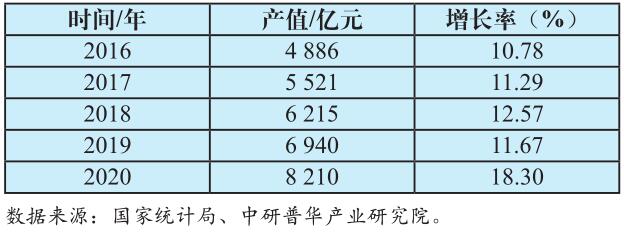
我国已经成为全球第二大医疗器械市场。根据[敏感词]统计局的数据,2020年全国共有医疗器械生产企业2.5万多家,经营企业89.7万多家,行业整体销售规模突破8 000亿元,约占全球医疗器械市场的20%(见表1)。目前,我国医疗器械与药品的销售额比例约为0.25:1,处于医疗器械的“黄金发展期”,未来这一比值若能够达到发达[敏感词]的1:1,市场规模将扩容近3倍。此外,人口老龄化也使得家用医疗器械市场需求显著提高。当然,行业如今技术水平低、研发投入低、产品附加值低、高端设备自主率低、市场集中度低的情况不容忽视,新问题、新情况层出不穷,因此建立法制化的市场环境,为医疗器械行业的持续发展保驾护航,才能实现医疗器械领域的“中国创造”,为推动健康产业新发展提供助力。
表1 2016—2020年中国医疗器械行业总产值及增长率
Tab.1 Total output value and growth rate of Chinese medical device industry (2016-2020)
2 医疗器械监管立法的国际经验总结
对医疗器械监管立法是国际社会普遍采取的监管措施,其中[敏感词]代表性的是美国、欧盟和日本,但是各主要[敏感词]和地区立法的形式和内容不尽相同,可以从多方面为我国医疗器械监管立法提供有价值的参考和经验借鉴。
2.1 美国:专门立法和与药品监管联合立法相结合
美国是世界上最早立法管理医疗器械的[敏感词],其相关法规和监管模式在国际上有很大的影响力。1976年,美国国会通过了《联邦食品、药品和化妆品法》(Federal Food, Drug, and Cosmetic Act, FD & C Act)修正案,确立了对医疗器械实行分类管理的办法。目前,分类管理办法已被普遍接受。
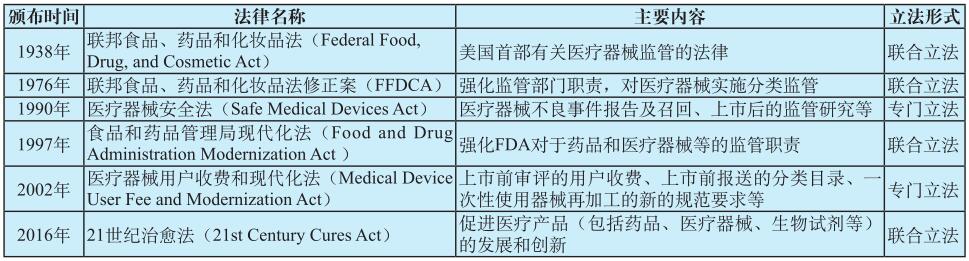
除了具有根本法性质的《联邦食品、药品和化妆品法》以外,20世纪90年代,美国国会还陆续通过了一系列的相关法案,形成了体系完备的医疗器械监管法律,其中有与药品等联合立法,也有针对医疗器械的专门立法,汇总如表2所示。
除此之外,FDA还在上述有关法律的基础上,制定了一系列的法规,汇编于《美国联邦法规》(code of federal regulations, CFR)的第 21部分(简称 21 CFR),其中相关医疗器械基本集中于第 800~第1 290 部分。
2.2 欧盟:医疗器械监管专门立法
欧盟(包括其前身欧共体)从1988年开始着手统一医疗器械监管的标准化问题,发布的法规为医疗器械监管的专门法,包括条例(regulations)、指令(directives)、指南(guidance documents)和欧盟医疗器械协调小组(medical device coordination group, MDCG)批准文件(medical device coordination group endorsed documents)等四种主要形式。
1990年以来欧共体(欧盟前身)先后颁布了有源植入医疗器械指令(active implantable medical devices directive, AIMDD)、医疗器械指令(medical devices directive, MDD)和体外诊断医疗器械指令(in vitro diagnostic medical devices directive, IVMDD)等三个医疗器械监管的核心指令,这三个指令在结构和内容方面十分相似,均包括产品风险分类管理、EC认证、合格评定和质量管理等内容,2007年对AIMDD和MDD部分条款进行了修订。
表2 美国现有关于医疗器械监管法律汇总
Tab.2 Summary of existing United States legislation on the regulation of medical devices
然而,随着欧洲一体化程度的加深,建立更加完善统一的医疗器械监管体制和产品标准的要求越来越高,欧盟议会于2017年5月发布的欧盟医疗器械条例(medical device regulation,MDR)和欧盟体外诊断医疗器械条例(in vitro diagnostic medical device regulation, IVDR),并要求于2021年5月26日正式生效,其适用范围覆盖欧盟27个成员国和5.1亿人口。新条例更加关注医疗器械临床性能、更好的可追溯性和对患者更大的透明度。此外,在欧盟的立法系统里,条例相比指令具有更高的效力层级、直接适用性和整体约束力。条例一旦生效,不需要转换为成员国法律就可以直接适用。指令与条例虽然具有相同的约束力,但是需要通过成员国当局转换进成员国法律方能适用。由此可见,欧盟对医疗器械领域监管立法的重视程度在不断提升。
欧盟现有关于医疗器械监管法律汇总如表3所示。
表3 欧盟现有关于医疗器械监管法律汇总
Tab.3 Summary of existing EU legislation on regulation of medical devices

2.3 日本:与药品等监管联合立法
日本是在亚洲地区最早进行医疗 器 械法 制 化 监 管 的 国 家 , 日 本 的 《 药 事 法 》(Pharmaceutical Affairs Law, PAL)起源于1943年,其后在1948年、1960年和1979年分别做出过重大修订,现行《药事法》为日本众议院在2002年7月通过,于2005年4月施行,新版《药事法》对涉及医疗器械监管部分做出了重大修改,用“医疗器械”代替了原来的“医疗用具”,并在原有的四级分类标准的基础上增加了按照危险程度进行分级管理的措施,医疗器械分为高度管理医疗器械、管理医疗器械和一般医疗器械,分类标准类似于我国现行的《医疗器械分类规则》中按照风险程度由高到低的第三类、第二类和[敏感词]类。上市许可分别采取审评注册、第三方机构认证和备案等方式进行。对于在日常使用、保养、检查和维修等方面有特殊要求的医疗器械,日本《药事法》将其纳入特定保养管理医疗器械,要求在医疗产品目录中予以注明,防止由于使用、保养等原因导致其对于临床上疾病的预防、治疗和诊断产生不利影响。
此外,日本自2015年开始实施新版《药品、医疗器械产品及再生/细胞疗法产品质量安全法》,新版法规则只要求生产厂商有质量管理体系(quality management system, QMS)证书并能够保证产品是按照QMS有关要求生产的即可,同时加强了厚生省对药品、医疗器械产品和再生/细胞疗法产品生产厂商进行不定期的“飞行检查”的要求。
由此可见,日本对药品、医疗器械等产品的监管立法更加强调上述产品的共性和规律性要求。因此,相关法规出台均延续了1960年以来的《药事法》确定的基本范围和结构,至今未发生重大变化,也未针对医疗器械监管出台专门的法规。
3 关于对医疗器械监管立法的可行性建议
我国医疗器械行业自身发展的基本规律和制度要求构成了对医疗器械监管立法的内在的必要性,我国当前全面推进依法治国的需要构成了对医疗器械立法监管的外在的必要性,这两个层面相互促进、相互协调,决定了立法活动势在必行。而从立法的政治保障、现实基础、探索和国际经验方面来看,我国当前着手开展对医疗器械监管立法的时机已经比较成熟了。
3.1 我国医疗器械监管立法已经具备基本条件
通过对美国、欧盟、日本等[敏感词]和地区医疗器械监管立法的研究,可以看出对医疗器械的监管采取立法形式已经成为国际通行的方式,并建立了完善的国际医疗器械监管的法律、法规和技术规范体系。我国作为全世界第二大医疗器械市场,出于保护和促进公众健康的需要,呼唤对行业监管尽快建立法制化的制度规则,同时,医疗器械行业的升级转型所需的行业发展的政策环境要求立法的及时性和政策的前瞻性。
此外,我国的医疗器械行业监管经过几十年的发展,目前已将医疗器械的研制、生产、经营、使用四个环节统一纳入监管范围,通过规范许可,设置医疗器械生产质量管理规范(good manufacturing practice, GMP)以及注册医疗器械的再评价、医疗器械的召回等制度,强化经营企业进货查验销售记录和使用单位的维修保养、使用记录等义务,基本形成了严密的、全链条的监管体系。特别是《医疗器械监督管理条例》自2000年颁布实施以来,经过2014年和2020年两次修订,对于医疗器械的监管理念和监管方式的探索都取得了长足进展,为我国医疗器械监管立法奠定了坚实的现实基础。
3.2 我国医疗器械监管立法应坚持的基本原则
法理学上,立法原则通常是指立法活动过程中必须要遵循的一些基本原则。我国立法的三个基本原则包括:科学原则、民主原则和法治原则。但具体到不同的部门法,又会有他们自己需要遵循的特有的立法原则。我国医疗器械监管立法应坚持的基本原则除上述基本原则外,还应当遵循以下基本原则:①医疗器械管理应当以人民健康为中心,坚持风险管理、全程管控、社会共治的原则;②医疗器械监管“四个最严”要求的原则,建立最严谨的标准,实施最严格的监管,实行最严厉的处罚,坚持最严肃的问责,以确保人民群众的医疗器械安全;③立法的现实性与前瞻性相结合的原则,坚持从我国当前医疗器械行业发展和监管的实际情况出发,实事求是,同时加强监管的前瞻性,防患于未然;④立法的规范性与实践性相结合的原则,着重加强安全监管,明晰主体责任,规范行业行为,落实行政执法与刑事司法衔接,严惩重处违法犯罪。
3.3 我国医疗器械监管立法应采取专门立法形式
结合我国医疗器械监管现状和各主要[敏感词]医疗器械监管法制化的实施经验,建议我国的医疗器械监管立法应采取单独立法的形式,也即通过专门的《中华人民共和国医疗器械管理法》,鉴于我国目前以及有实施且体系完善的《中华人民共和国药品管理法》,若仿照美国和日本等国,将使得这部法律内容体系更为庞大,结构更加复杂,而单独立法则有利于增加法律的针对性和灵活性。立法筹备工作宜由全国人大常委会法制工作委员会和[敏感词]药品监督管理局共同组织,在现行《医疗器械监督管理条例》(国务院令第739号)的基础上,研究和总结医疗器械监督管理领域中的原则性和规律性内容,并将其以《医疗器械管理法》的形式确定下来。其作为我国对于医疗器械监管的基本法,必将对我国医疗器械行业建立法制化运行规则和健康发展产生积极而深远的影响。
参考文献
[1] 吕允凤, 邓刚. 浅析中国、美国和欧洲关于医疗器械代理人的法规要求[J]. 中国食品药品监管, 2021, (7): 78-83.
[2] 屈宝刚. 美国医疗器械法规介绍[J]. 中国医疗器械信息, 2005, 11(1): 24-25.
[3] 张春青, 周良彬, 王越, 等. 欧盟新法规医疗器械分类管理思路变化的研究分析[J]. 中国医疗器械杂志, 2018,42(3): 202-205.
[4] 李耀华, 塔娜. 我国医疗器械指导原则的现状分析与建议[J]. 中国医疗设备, 2020, 35(9): 128-131.
[5] 陈智慧. 浅谈欧盟体外诊断医疗器械新法规[J]. 中国医疗器械杂志, 2021, 45(5): 530-535.
[6] 李非, 孙智勇, 张世庆, 等. FDA的医疗器械监管科学:最小负担原则及应用[J]. 中国食品药品监管, 2021(1):48-60.
作者:马晓彬 1 , 洪亮 2
1 云南省医疗器械检验研究院,昆明市,650106
2 昆明医科大学药学院 暨云南省天然药物药理重点实验室,昆明市,650500





