【作 者】王伟明,李路明,郝红伟,刘方军,文雄伟,胡春华,马伯志,清华大学航天航空学院,北京市,100084
【摘 要】目的:我国当前产业发展呼唤完善的高风险有源植入式医疗器械标准,探讨标准制定的问题和思路。
方法:分析我国有源植入医疗器械标准现状,对有源植入医疗器械国际标准举例,分析高风险有源植入医疗器械这一蓬勃发展的领域,国际标准制定的问题,思路和趋势。结果:依据中国医疗器械产业实际自主研发制定标准的能力,是我国有源植入医疗器械标准当前发展的瓶颈。我国自主研发,具有自主核心技术的有源植入式医疗器械,对应的自主标准研究,正是推动中国标准国际化的契机。结论:完善以技术为依托的我国自主创新有源植入式医疗器械标准。结合我国自主研发,在现有国际标准问题基础上深入研究,进一步完善和发展国际标准,进行引领国际标准的高水平技术标准研究。
【关 键 词】有源植入式医疗器械;神经刺激器;国际标准现状和趋势;标准研究

0 引言
为适应[敏感词]标准化工作的发展,在[敏感词]药品“十二五”规划中的医疗器械标准化体系建设研究中明确了加大对高风险产品技术标准和具有自主核心技术的标准研究的支持 [1]。
有源植入式医疗仪器属于高风险医疗器械,包括植入式心脏起搏器、植入式神经刺激器、植入式输液泵、植入式循环支撑装置以及植入式人工耳蜗等。目前我国市场上绝大多数此类产品被国外大公司所垄断,近年来国内厂家也陆续开始研发和生产。但绝大部分此类产品在国内缺乏体系完善的标准指导,这使得相关的检测、审评和日常监管等缺乏明确的依据,制约了相关产业的快速发展。产业发展呼唤完善的高风险有源植入式医疗器械标准。因此,需要加快有源植入式医疗仪器方面的国行标的制定速度 [2] 。
当前,国内医疗器械产业自主创新的标准少,尤其是关于高技术产品的标准就更少。近年来,一些高风险、需重点监管的高技术产品在进行注册检验时,经常出现没有对应的国内标准可参考,不得不直接使用境外类似产品的注册标准。我国医疗器械标准的基础研究力度偏低,标准质量和水平有待提高。标准制定机构对新技术标准多数依赖发达[敏感词],需以积极的态度独立自主地开展技术的基础研究工作 [3-4] 。
目前,各国都把医疗器械产业发展提升到[敏感词]战略层面,重视国际间的标准竞争,将医疗器械标准战略作为未来引领[敏感词]经济发展的重要手段 [3, 5] 。随着国际市场贸易自由化的推进,标准已经成为发达[敏感词]新贸易保护主义的主要表现形式。利用标准本身“规范市场秩序”的属性,合法而隐蔽地把标准作为技术壁垒的主要手段,达到保护本国产业的目的。只有完善以技术为依托的我国自主创新医疗器械标准,才能在激烈的国际标准竞争中胜出。提高标准自身的研发能力是医疗器械标准化进程中不可忽视的环节。不论在我国自行研制标准中,还是在转化国际标准中,研究制定科学合理的技术指标和检验方法都是制定标准的最基本要求 [6-7] 。标准的基础研究对产业的影响是长远的。要利用具有自主知识产权的医疗器械产业强势发展的契机,推动我国标准的国际化发展。依托我国自主研发、具有自主核心技术的有源植入式医疗器械 [8-9] ,开启相应的自主标准研究,正是推动中国标准国际化的契机。
1 完善以技术为依托的我国自主创新有源植入式医疗器械标准
近年来,国内大部分医疗器械标准是直接从国际标准转化而来,存在的问题比较突出。文献[10]指出相当数量标准的起草工作由各标技委秘书处所在地的检测人员直接翻译国际标准,往往导致标准验证工作缺乏专业生产企业及其它相关人员的参与,验证数据不够充分,有时导致新发布的标准实施困难。文献[5]指出转化过来的标准不符合中国国情,或者检测所需仪器设备不同,或者常用的验证方法不同,造成了转化来的标准不能服务于中国医疗器械产业的尴尬局面,也就呈现出转化标准可利用价值不高,质量不高的现象。而现今的国际标准,为了达到贸易保护的效果,越来越多的呈现出垄断性和隐蔽性的特点,我国有必要建立属于自己的医疗器械标准,不再实行国际标准的拿来主义。文献[11]指出医疗器械标准中的方法部分缺少可操作性。试验方法的描述和规定是现有医疗器械标准中最薄弱的环节。标准方法没有可操作性的主要原因正是相当一部分医疗器械标准是由国际标准简单翻译而来,没有经过细致缜密的标准验证。国际标准是在国际范围内认可的标准,大多是指南性的标准,由于各国法规和技术条件不同,所以不会对每项性能指标的方法进行细致阐述。否则,会造成各国在不同国情下不必要的束缚,而违背了国际标准众人共享,多方共赢的初衷。但是国际标准在转化为我国标准之后,将作为我国的[敏感词]标准和行业标准,此时标准处于具体的国情、法规和技术条件下,针对的是具体的产品,就不应该是指南性的标准,而应该是可以操作的细节性标准,应该在对国际标准进行细致缜密的标准验证之后,转化为技术上可行的[敏感词]标准或者行业标准。让国内的企业,检验机构以及监管机构都能够在各自负责的环节,共用一份医疗器械标准,而不会在技术层面引发不一致声音,真正维护标准的权威性和严肃性。
不论在我国自行研制标准中,还是在转化国际标准中,研究制定科学合理的技术指标和检验方法都是制定标准的最基本要求 [6-7] 。
2 高风险有源植入式医疗器械中国标准的国际化
近年来我国医疗器械产业迅速发展,但标准化基础研究不够,依据中国医疗器械产业实际自主研发情况制定标准的能力还比较薄弱,重要的医疗器械标准还是以等同转化国际标准为主 [10, 12-13] 。随着2010年[敏感词]食品药品监督管理局标准管理中心成立 [3] ,一些问题 [10, 12-13] 逐步解决。但有二个问题还需引起重视,并有实质性推动:一是企业和科研队伍的参与问题;二是提高标准自身的研发能力这一关键核心问题。目前,政府还未能建立起促进企业参与标准化工
作的合作平台。从标技委人员组成结构看,检测机构等政府部门人员较多,企业、科研院所人员在标技委工作中的决策分量不够,专业人才匮乏 [3] 。
从文献看,我国围绕产品标准的专题研究较少,研究的系统性和连续性不强,研究内容也仅局限于国际标准的转化,[敏感词]标准关键项目的研究和标准编制要求等内容,特别是有源产品的[敏感词]标准和行业标准研究始终滞后于国际步伐。目前[敏感词]检验机构是从事标准研究的核心力量,企业和科研机构的参与度很低。企业作为产品标准制定的重要主体,应当加大标准研究力度,提升产品标准水平。科研机构作为核心技术的创新来源,仅有少量文献发表,表明对标准研究的投入不够,今后有待加强与企业的产学研合作联动,加速科研成果转化,促进我国医疗器械产业升级 [14] 。 标准自身研发能力的影响体现在各方面。比如,研发能力弱就无法实质性参与医疗器械国际标准化工作 [1] 。
高风险有源植入式医疗器械中国标准要与时俱进,技术以自主研究为主,结合文献,辅以FDA-PMA(Premarket Approval Application)等体现出来的审评技术内容,以及FDA等各国召回体现出来的问题,预测标准技术内容趋势,争取行业标准引领国际标准,做部分产品国际标准提案。国际视野和自主研究相结合,这应为我国高风险产品技术标准和具有自主核心技术的标准研究的具体实施路线。我国目前通过企业和科研机构的实质参与,可以进入对这个领域有着实质推动的阶段,进一步引领国际标准,实质性参与医疗器械国际标准化工作。
3 植入神经刺激器国际标准举例分析
从举例分析中,看高风险有源植入式医疗器械这一蓬勃发展的领域,国际标准制定的问题,思路和趋势。
3.1 对病人热伤害的保护
目前,国际上关于有源植入式医疗器械标准主要采用国际标准化组织(ISO)颁布的ISO 14708系列标准,欧盟颁布的EN 45502系列标准和美国医疗促进协会AAMI系列标准。对植入式神经刺激器主要涉及前两个标准系列。
ISO 14708-3:2008(手术植入物,有源植入式医疗器械,第3部分:植入神经刺激器)规定,在正常或单一故障状态下,植入式神经刺激器的植入部分外表面温度不应超过正常人体表面温度2℃。该要求与EN 45502-1:1998(有源植入医疗设备 第1部分:安全性,标识和由制造商提供的信息的一般要求)温升要求一致。
2015年充电胃刺激器(MAESTRO Rechargeable System) PMA(Premarket Approval Application)报告安全性和有效性数据总结中 [15] ,见图1,写明在充电和治疗过程中,温升不超过2℃。

那么,FDA审批上市后,在售充电神经刺激器类产品的应用情况如何呢?近年可充电技术已用于植入医疗器械,以获得更长的电池寿命以减少手术更换,但在植入领域应用发热问题非常突出。植入式医疗仪器一般使用生物相容性的金属钛密封,由于充电电磁耦合过程中钛外壳存在涡流效应等影响,极易引发充电过程中植入式医疗仪器发热的问题。2012年,因充电发热问题引发了大规模召回事件。FDA对知名厂商St.Jude medical公司Eon TM 和Eon Min TM 充电脊髓刺激器(SCS)产品展开大规模召回,共涉及75 663台,在充电过程导致3例病人植入部位皮肤烫伤,其中2例一级烧伤、1例二级烧伤,有72例病人由于热伤害而不得不进行植入仪器的移除手术 [16] 。
和上述FDA召回相对应,文献[17-18]对世界上神经刺激类器械的三个主要生产厂家生产的神经刺激器产品在充电过程中的发热进行了对比研究,见图2,结果统计[敏感词]温升为3~8℃。
ISO 14708.3:2008和EN 45502-1:1998规定植入部分外表面温升不超过2℃,PMA报告也体现出温升小于2℃,符合标准,充电植入式神经刺激器获批上市,然后出现上市后FDA因病人烧伤大规模召回。出现这一问题的主要原因是充电温升在不同测试条件和测试方法下差别较大,但标准未给出相应规定。毫无疑问,标准在对病人热伤害的保护这一点上有待改进,国际标准未能跟上新技术新产品的发展。
因为标准试验方法描述不明确,以及产品新特性的涌现等情况,上述类似问题突出。但这一情况在新版标准中有调整。ISO 14708.1:2014(手术植入物—有源植入式医疗器械—第1部分:安全、标记及制造商提供信息的一般要求)中,与[敏感词]版ISO14708.1:2000相比,附录新增如下内容:即规定2℃的温度限制不包括有源植入式医疗仪器充电部分,核磁(MRI)部分等。毫无疑问,充电和MRI的温升技术指标和测试方法是国际标准未来需要覆盖的内容,需要深入研究。
标准上述调整很快体现在FDA审评,脊髓刺激器这种功耗较大,充电电流较大的神经刺激器产品,在2015年Senza Spinal Cord Stimulation PMA报告安全性和有效性数据总结中随即体现出不同于2℃限制的特点:充电过程42℃平均约23 min([敏感词]约90 min)。

这样从ISO 14708.1:2014发布起,就可以理解为当前制造商自己证明更高的温度对特定的应用是合理的即可。毫无疑问这样同样可能发生烧伤召回的风险,可预测下一步ISO会在ISO 14708.2到ISO 14708.7,涉及充电和MRI相容产品的各专标中规定温升测试方法和通行准则。无法在ISO 14708.1中统一体现,是因为各植入部位温度耐受能力不同,不同产品特点有差别导致发热不同,无法一概而论。我国国行标完全可以在自主研究的基础上,致力于解决国际标准当前的问题,有效避免大规模召回这种情况的发生。
3.2 电磁兼容
当前有源植入医疗器械标准体现出一个重要趋势,就是一个标准内容要完善到足够做出科学评判。这样对厂商,检测和审评机构都非常有利。如ISO 14708.3有关电磁兼容内容全面,充分考虑到神经刺激器的产品特点,同时和通用的电磁兼容标准有很好的切合度。再如ISO/TS 10974:2012(MRI安全性评估-AIMD有源植入医疗器械),引用了相关的IEC,ASTM,ANSI/AAMI等标准,又针对有源植入物特点做了较大比例项目新增,标准完善,依据这一个标准,即可判定有源植入医疗器械核磁安全性。
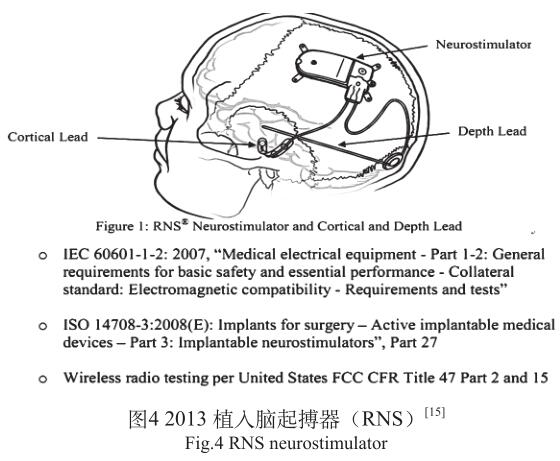
从PMA报告安全性和有效性数据总结中 [15] ,以神经刺激器电磁兼容和无线技术部分为例,也可以清晰地看到这一特点。以前同类产品电磁兼容和无线技术部分会引用一系列标准,很多是厂商根据产品特点自行选取,因产品特点不同,实际上检测和审评机构很难判定标准引用是否合适,覆盖是否全面和通行准则是否合适。随着专标内容日趋完善,近期神经刺激器类产品一般电磁兼容和无线技术部分3个标准就可以,见图4。电磁兼容,植入物ISO 14708-3,配套体外产品IEC 60601-1-2。无线技术根据经皮无线通信方式选取FCC相应部分。专标覆盖全面,方法和合格判决统一是有源植入医疗器械标准的发展趋势,也是我国制定国行标的重要指导原则,要在这个层面引导标准的制定。
另外,在技术标准战略中,标准和专利结合,有其必然性 [19] 。ISO 14708.3:2008,电磁兼容条款27.103-105测试方法描述不具体,笔者与标准制定机构联系。回复这一版本重在建立概念,测试方法细节后续版本会改善;同时,回复提到专利。这点在国行标的制定中需要注意。ISO 14708.3:2008测试方法待完善。完善的高水平的国行标的建立对加速我国检测和审评非常必要。高水平国行标制定,需要相应自主研发能力做支撑,同时要清楚国际通行适用标准。以我国有源植入式医疗器械产业化为契机,引领有源植入式医疗器械标准国际标准。
3.3 对机械力的防护
机械力在临床上导致问题较多,一旦发生问题需手术取出,举例如图5所示。
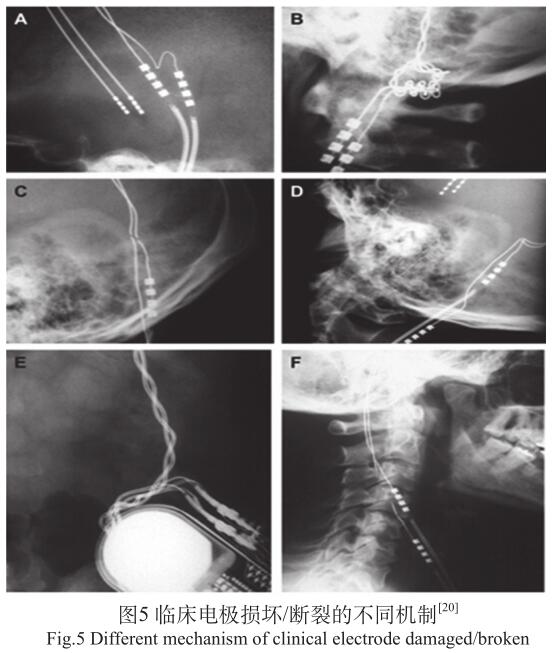
对有源植入医疗器械产品,机械力防护在产品设计、检测和审评过程中最难把握。机械力准则比较繁杂,即便同为神经刺激类产品差别也较大,机械力是国际标准和FDA最难把控的部分,对新产品标准容易跟不上,现有的国际标准也存在不完善问题。如VNS(迷走神经刺激器),无专标,机械力通常引用其他标准,但具体测试方法和通行准则不同。标准不完善的直接结果反映在大量的临床不良事件报道和FDA召回上,例如迷走神经刺激器,从1997到2011年,FDA有上千条关于电极断裂或疑似断裂的不良事件报道,还有电极断裂FDA召回。脊髓刺激器临床也有电极断裂的问题。ISO 14708系列是针对有源植入式医疗器械的标准,其中ISO 14708.3是针对神经刺激器类产品,但神经刺激器类产品因刺激部位的不同(大脑、迷走神经、脊髓等),对电极结构和刺激信号的要求是不同的。因此对于神经刺激器类产品应进一步深入探讨。从标准的版本内容变更中也不难看出上述问题。
ISO 14708.1:2014与ISO 14708.1:2000比,机械力防护主要有2点变更。一是增加了23.7 机械冲击测试,主要考虑手术过程中误操作导致的轻微冲击对植入部件的破坏。考虑到医生操作可能带来的问题,是个进步;二是23.6扭转拉伸试验有重大变更。ISO 14708.1:2014去掉了ISO 14708.1:2000规定的扭拉试验的具体试验方法和合格判据,增加强调了医生重新连接的性能保证。新版标准这样调整在情理之中,因为ISO 14708.1覆盖了各类有源植入式医疗器械产品,而各产品设计差别较大,植入部位不同,很难规定统一的试验方法和合格判据。ISO 14708.1:2000规定的通过判据对部分有源植入类医疗器械过于严苛。其不合理性决定了调整的必然性。有源植入医疗器械国际标准中机械力未来调整趋势应该是在ISO 14708.1中总述各试验项目,在各具体产品标准中,如神经刺激器专标ISO 14708.3中规定具体试验方法和合格判据。我国国行标制定要能够准确把握国际标准发展趋势。
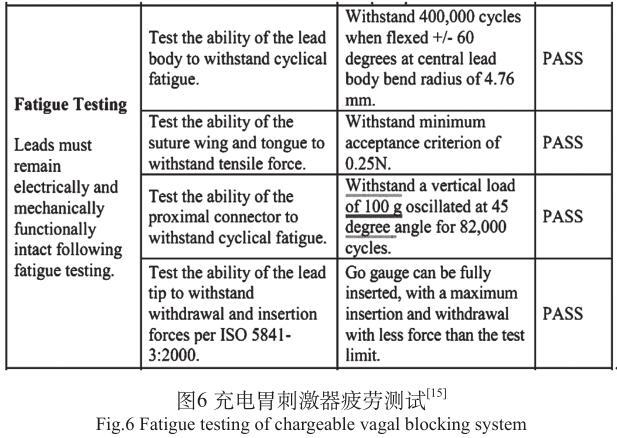
2015年充电胃刺激器(MAESTRO Rechargeable System) PMA报告安全性和有效性数据总结中 [15] ,以疲劳测试为例,见图6,大部分项目没有明确的标准依据,为厂家自定;部分项目为对心脏起搏器标准的引用。对有源植入医疗器械这一蓬勃发展的领域,新产品的机械力标准要跟上,这点国际标准正在逐步改善。
迷走神经刺激器,现行国际标准未包括,但在知名厂商Cyberonics公司的FDA-PMA中包括的内容有:dv/dt测试、缠绕在迷走神经上电极的力学指标(可能造成神经损伤和副反应)等。VNS标准研究进展慢的主要原因是世界上仅此一家,病人又很需要,随着我国公司自主研发和检测机构的加入,这一状况会有所改善。
当前现状下,针对FDA和CFDA对厂家自行制定测试项目把控能力有差别,国内和国外企业对技术指标理解有差别,在我国国行标制定中需要体现出比当前国际标准更高的要求。尽量在标准中明确具体实验方法和通行准则,研究制定科学合理的技术指标和检验方法是制定标准的最基本要求,这也是国际标准努力的方向。我国要尽快加强相关标准工作。避免因为测试不全面或测试方法或通行准则问题,而导致因电极在人体内断裂或连接等问题引起的临床患者手术取出的应用风险。随着产业的发展,我国可考虑做神经刺激器类产品国际标准提案。
3.4 植入元器件和电气相关可靠性标准
这部分涉及整机,关键植入部件标准如电容和电池等未来要回答的问题,对应FDA召回较多 [15] 。植入元器件和电气相关标准待建立,需要有源植入医疗器械产业界更多的积累,国际上一直努力推动中,国际电子生产商联盟(iNEMI)曾发起“植入医疗仪器可靠性要求”的主题调查,目前我国还没有相关的研究。国际电子生产商联盟2009年还开展了有源植入医疗仪器电子元器件失效机理、接受标准和加速测试过程的讨论,进行了失效分析和随后的加速失效测试。项目参加者包括[敏感词]标准与技术研究所、FDA和厂家等。联合研究是技术标准研究的一个重要特点。
4 讨论和结论
我国医疗器械产业发展呼唤完善的高风险有源植入医疗器械标准。依据中国医疗器械产业实际自主研发制定标准的能力,是当前有源植入医疗器械标准发展的瓶颈。
我国有源植入医疗器械标准要考虑中国目前国情,FDA和CFDA的审评水平差别,国内和国外企业的差别,考虑我国审评和检测机构的具体需求。密切跟踪FDA有源植入医疗器械召回和相关临床文献,结合我国自主研发,在现有国际标准问题基础上深入研究,进一步完善和发展国际标准,进行引领国际标准的高水平国行标前期技术研究,做国际标准提案。
[敏感词]需进一步加大对高风险产品技术标准和具有自主核心技术的标准研究支持,推进以技术为依托的我国自主创新有源植入医疗器械标准建立。当前企业作为产品标准制定重要主体,科研机构作为核心技术创新来源,标准研究参与不够。当前我国自主研发,具有自主核心技术的有源植入医疗器械 [8-9, 21] 对应的自主技术标准研究,正是推动中国标准国际化的契机。
参考文献
[1] 母瑞红, 李静莉. 探索建立促进产业发展的医疗器械标准化工作新模式[J]. 中国医疗器械信息, 2013, (9): 25-27.
[2] 刘毅, 孟志平. 高风险有源植入式医疗器械标准要求及异同分析[J]. 医疗装备, 2015, 28(1): 5-8.
[3] 杜然然. 我国医疗器械标准化建设的协同机制研究[D]. 北京: 北京协和医院, 2012.
[4] 杜然然, 欧阳昭连, 郭柯磊, 等. 我国医疗器械标准现状与存在问题探讨[J]. 医学研究杂志, 2012, 41(11): 201-204.
[5] 梁晓婷, 池慧, 杨国忠. 欧洲、美国、日本医疗器械标准管理及对我国的启示[J]. 中国医疗器械信息, 2008, 14(8): 37-52.
[6] 杨晓芳, 王越, 母瑞红, 等. 我国医疗器械专业标准化技术委员会管理现状及分析[J]. 医疗装备, 2014, 27(10): 16-18.
[7] 杨晓芳, 母瑞红, 李静莉. 我国医疗器械标准质量评价初探[J]. 中国医疗器械杂志, 2014, 38(5): 383-385.
[8] 李路明, 王伟明, 郝红伟, 等. 用于植入式医疗仪器的经皮闭环控制充电装置[P]. 2013.1, ZL201010293866.8.
[9] 李路明. 可充电脑起搏器的研发与产业化[J]. 中国医疗器械信息, 2015, (7): 39-41.
[10] 储云高, 朱颖峰, 钱红, 等. 我国医疗器械标准体系建设的几点建议[J]. 上海食品药品监管情报研究, 2012, (117):21-26.
[11]杨晓芳, 王春仁, 杨昭鹏, 等. 从医疗器械注册检验角度看待医疗器械标准体系的问题与发展[J]. 生物医学工程学杂志,2013,30(3):546-551.
[12] 李悦菱, 廖晓曼, 刘毅. 我国医疗器械标准现状及问题分析[J].医疗装备, 2014, 27(12): 36-38.
[13] 杜然然, 欧阳昭连, 陈微, 等. 基于技术创新协同机制的中国医疗器械标准化建设[J]. 北京生物医学工程, 2014, 33(6): 641-645.
[14] 周冬, 张弦, 杨士友. 我国医疗器械标准研究文献分析[J]. 中国药业, 2014, 23(22): 8-10.
[15] http://www.fda.gov/default.htm
[16] http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRES/res.cfm
[17] Smith DK, Lovik RD, Sparrow EM, et al. Human tissue temperatures achieved during recharging of new-generation neuromodulation devices[J]. Int J Heat Mass Transfer, 2010,53(15): 3292-3299.
[18] Lovik RD, Abraham JP, Sparrow EM. Surrogate human tissue temperatures rmplant during recharging of a neuromodulation device[J].
Neuromodulation, 2011, 14(6): 501-509.
[19] 陈亮. 知识经济时代下的标准竞争研究[D]. 北京: 首都经济贸易大学, 2004.
[20]Guridi J, Rodriguez-Oroz MC, Alegre M, et al. Hardware complications in deep brain stimulation: electrode impedance and loss of clinical benefit[J]. Parkinsonism Relat Disord, 2012, 18(6):765-769.
[21] 陈少波. 电磁感应式经皮能量传输的热安全研究[D]. 北京: 清华大学, 2014.








