中美化学仿制药参比制剂选择与管理的对比及启示
2023-01-27
[摘要]参比制剂是仿制药研发的标杆和基础。本文介绍了我国化学仿制药参比制剂的遴选工作背景、遴选原则和路径,美国参比制剂的确定及管理模式,通过分析中美两国参比制剂选择管理的异同,为进一步完善我国参比制剂遴选及管理工作提供参考。 近年来,为提高仿制药质量和药品审批标准,我国开展了仿制药质量和疗效一致性评价工作……
2022年已发布医疗器械共性问题汇总
2023-01-24
2022年,器审中心进一步落实国务院“放管服”改革要求,更好地服务行政相对人,围绕业内人士关注的审评热点问题,定期发布共性问题解答,2022年共发布97条共性问题答疑,现汇总如下。 2022年已发布医疗器械共性问题汇总 ……
2022年已公开医疗器械审评报告汇总
2023-01-21
2022年,为全面贯彻落实国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)文件精神,提高审评审批透明度,器审中心先后公开97份创新、优先产品技术审评报告,现梳理汇总如下。 2022年已公开医疗器械审评报告汇总 ……
2022年已发布医疗器械指导原则汇总
2023-01-18
2022年,为加强医疗器械产品注册工作的监督和指导,进一步提高注册申报资料质量,提升审评效率,器审中心组织拟订了95项医疗器械注册审查指导原则,并已发布实施。 2022年已发布医疗器械指导原则汇总 ……
GB 9706.1-2020检测常见问题
2023-01-12
01、GB 9706.1-2020与GB 9706.1-2007的差异有哪些? 答:国家药品监督管理局医疗器械标准管理中心组织全国医用电器标准化技术委员会开展研究,按新旧标准条款顺序形成了《GB 9706.1-2007、GB 9706.15-2008、YY/T 0708-2009和GB 9706.1-2020对照……
国家器审中心发布医疗器械共性问题答疑汇总
2023-01-12
2022年,国家器审中心围绕业内人士关注的医疗器械审评热点问题,定期发布共性问题解答,为方便大家查阅,现将国家器审中心2022年7月-12月期间发布的医疗器械共性问题答疑整理汇总如下: 问:创新审查结果告知后申报注册时限的相关情况说明 答:根据《创新医疗器械特别审查程序》(2018年83号)……
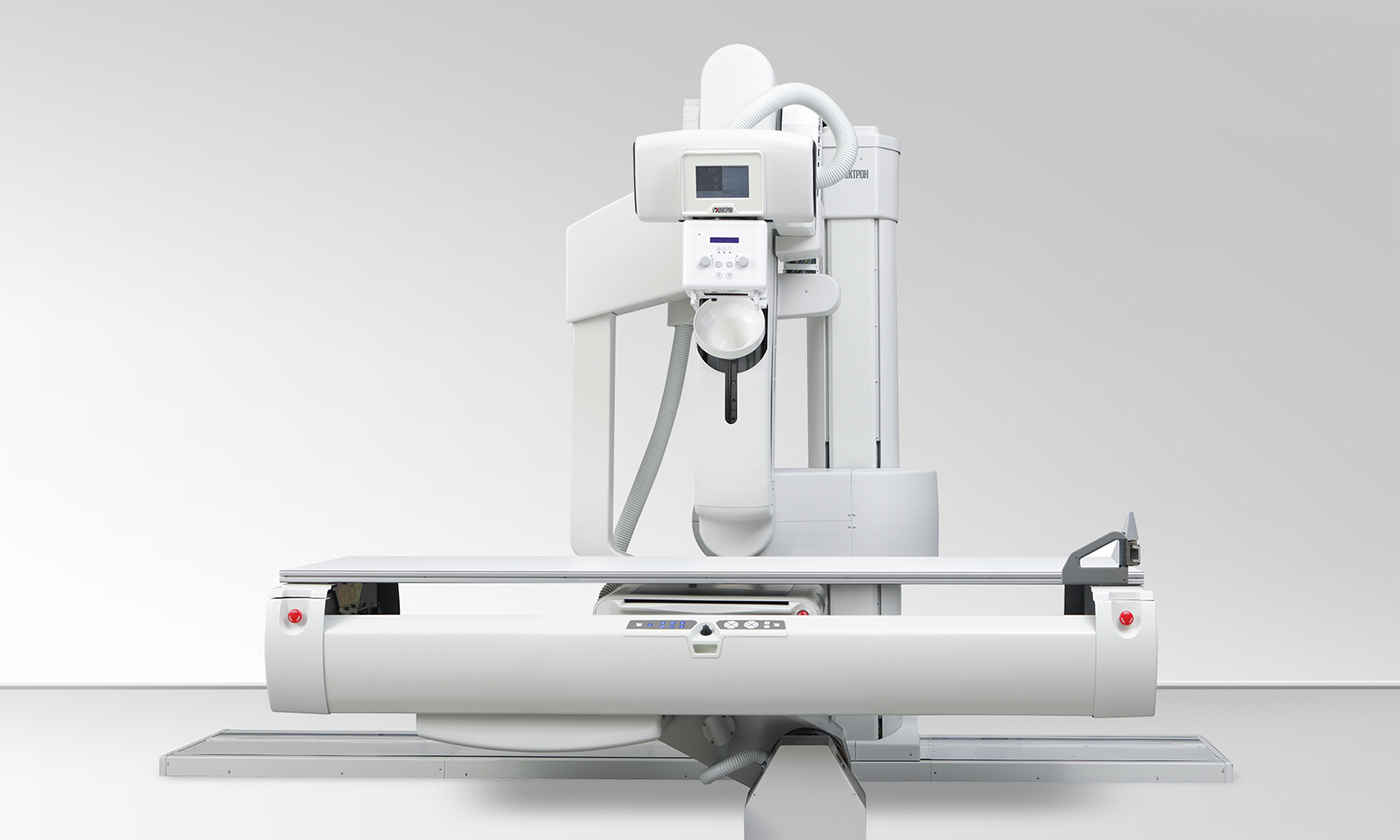
含儿科应用的医用诊断X射线设备研发实验要求与主要风险
2023-01-11
含儿科应用的医用诊断X射线设备是指预期专用于儿科人群或者适用人群包含儿科人群的X射线成像设备(除非设备的设计不允许在体型较小的儿科人群患者使用)。 一、含儿科应用的医用诊断X射线设备主要风险 含儿科应用的医用诊断X射线设备主要风险见表1: 表1 产品主要危害 ……
新生儿蓝光治疗仪研发实验要求与主要风险
2023-01-11
新生儿蓝光治疗针对未结合胆红素增高为主的新生儿高胆红素血症,利用主要波段为蓝光的可见光对新生儿体表进行照射。带有新生儿蓝光治疗功能的婴儿培养箱、婴儿辐射保暖台等产品也可以参考本文。 新生儿蓝光治疗设备在《医疗器械分类目录》的分类编码为09物理治疗器械-03光治疗设备-06 蓝光治疗设备,管理类别为第二类。 ……
超声清洗对器械的影响
2023-01-11
1、实际问题 经过一段时间超声波清洗后一些器械表面镀铬层会脱落,失去特有的银色金属光泽,呈现黄色、黑色的金属底色。以一些器械如扩阴器、吸引器等代表性器械在超声波清洗机中清洗后表现比较突出。 那么在实际应用中,说明有的器械在使用超声波清洗器对器械处理后,器械损伤会比较快,大大地缩短了器械的使用……
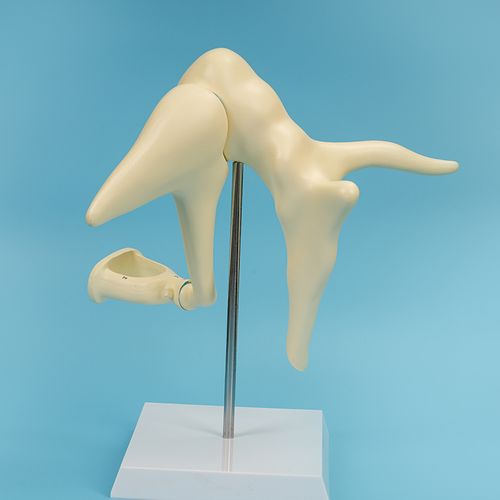
听小骨假体产品研发实验要求与主要风险
2023-01-10
听小骨假体用于整体或者部分听骨链重建,听小骨假体的制造材料通常为纯钛、钛合金、不锈钢、铂金属、羟基磷灰石、聚四氟乙烯等。采用增材制造或组织工程技术制造的听小骨假体可参考本文中适用的内容。 根据《医疗器械分类目录》,分类编码为13-08-01,管理类别为Ⅲ类。 一、听小骨假体产品主要风险 ……
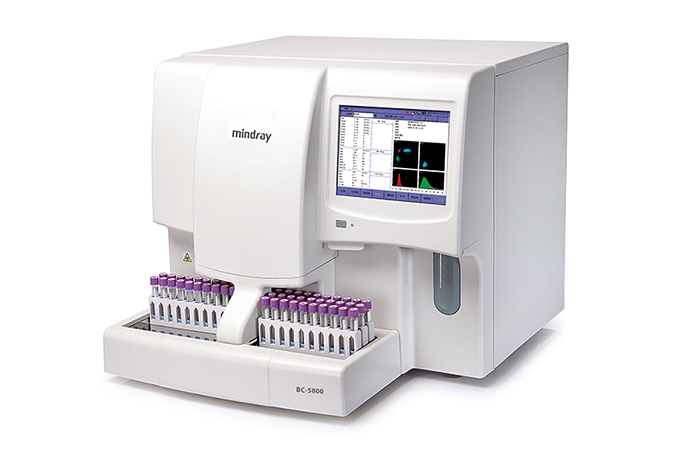
血细胞分析仪研发实验要求与主要风险
2023-01-10
本文适用于对血液中有形成分进行定量分析,并提供计数、类别、浓度、体积、细胞发育状态等相关信息的血细胞分析仪。管理类别为Ⅱ类,产品分类编码为22-01-02。 一、血细胞分析仪结构组成与工作原理 1.通常由血细胞检测模块、血红蛋白测定模块、机械模块、电子模块、软件等组成。 1.1血细胞检……