口咽/鼻咽通气道注册审查指导原则(征求意见稿)
2022-11-22
口咽/鼻咽通气道注册审查指导原则 本指导原则旨在指导注册申请人对口咽/鼻咽通气道注册申报资料的准备及撰写,同时也为技术审评部门对口咽/鼻咽通气道注册申报资料的技术审评提供参考。 本指导原则是对口咽/鼻咽通气道的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的……
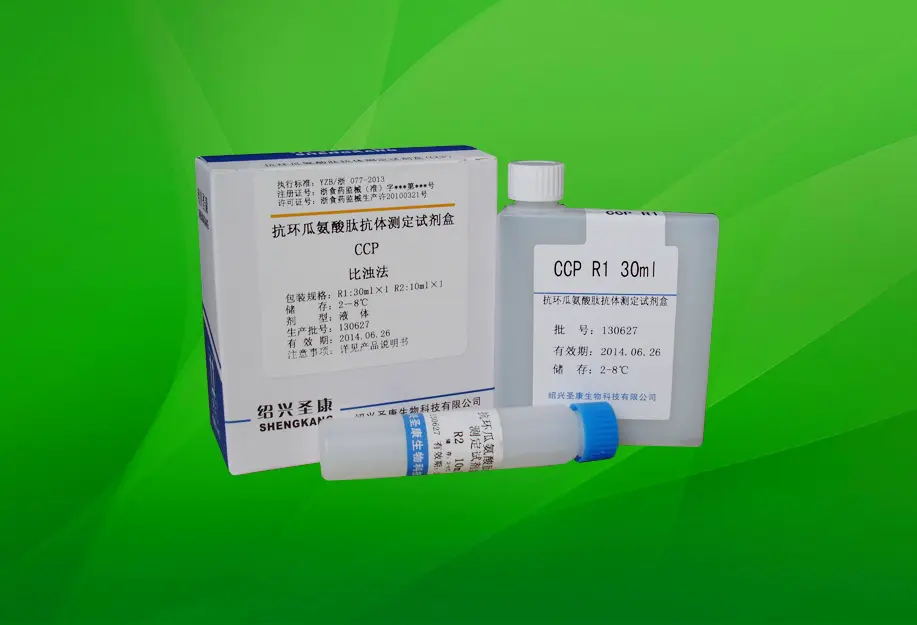
抗环瓜氨酸肽抗体检测试剂注册审查指导原则(征求意见稿)
2022-11-21
抗环瓜氨酸肽抗体检测试剂注册审查指导原则 本指导原则旨在指导注册申请人对抗环瓜氨酸肽抗体检测试剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是对抗环瓜氨酸肽抗体检测的一般要求,申请人应依据产品的具体特性确定其中的具体内容是否适用,若不适用,需具体阐述理由及相应……
甲氨蝶呤检测试剂注册审查指导原则(征求意见稿)
2022-11-21
甲氨蝶呤检测试剂注册审查指导原则(征求意见稿) 本指导原则旨在为医疗器械注册申请人(以下简称“申请人”)进行甲氨蝶呤检测试剂的注册申报提供技术指导,同时也为医疗器械监督管理部门对注册申报资料的审评提供技术参考。 本指导原则是对该类试剂注册申报资料的一般要求,申请人应依据产品的具体特性确定其中内容是否……
呼吸系统过滤器注册审查指导原则(征求意见稿)
2022-11-21
呼吸系统过滤器注册审查指导原则(征求意见稿) 本指导原则旨在指导注册申请人对呼吸系统过滤器(Breathingsystemfiliter,简称BSF)产品注册申报资料的准备及撰写,同时也为技术审评部门提供参考。 本指导原则是对呼吸系统过滤器产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容是否……
革兰阳性菌鉴定试剂注册审查指导原则(征求意见稿)
2022-11-19
革兰阳性菌鉴定试剂注册审查指导原则 本指导原则旨在指导注册申请人对革兰阳性菌鉴定试剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是对革兰阳性菌鉴定试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产……
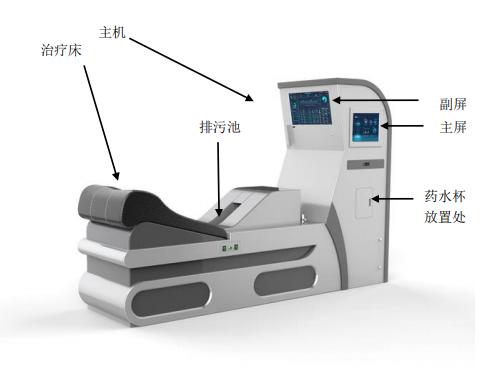
肠道水疗机注册审查指导原则(征求意见稿)
2022-11-19
肠道水疗机注册审查指导原则(征求意见稿) 本指导原则旨在指导注册申请人对肠道水疗机注册申报资料的准备及撰写,同时也为技术审评部门提供参考。 本指导原则是对肠道水疗机的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报……
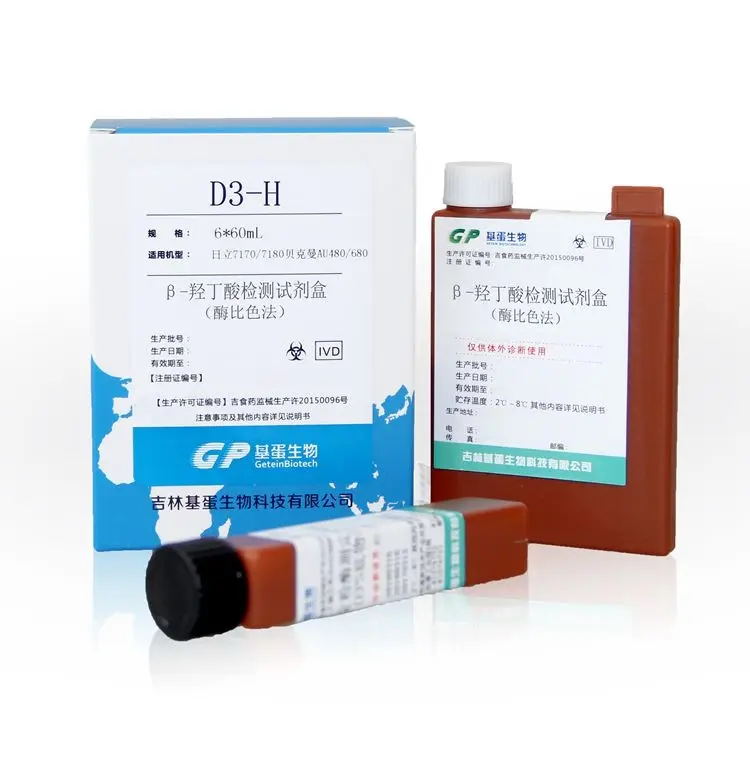
β-羟丁酸检测试剂注册审查指导原则(征求意见稿)
2022-11-19
β-羟丁酸检测试剂注册审查指导原则(征求意见稿) 本指导原则旨在指导注册申请人对β-羟丁酸检测试剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是针对β-羟丁酸检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科……
《北京市医疗器械审评核查咨询问答300问》之临床检验产品
2022-11-18
1.第二类体外诊断设备的产品技术要求中,环境试验还要求吗? 答:按照《医疗器械产品技术要求编写指导原则》相关精神,环境试验可不在产品技术要求中体现。但是相关研究还是应在产品研发过程中体现,并在注册申报时提交相关研究资料。 2.说明书中主要组成成分应包括哪些? 答:应包括最小销售……
医疗器械产品适用强制性标准清单和使用说明
2022-11-18
医疗器械产品适用强制性标准清单使用说明 为贯彻落实习近平总书记“四个最严”要求,落实新法规相关规定,进一步明确医疗器械强制性标准(以下简称“强标”)的适用情况,经征求国家药品监督管理局医疗器械标准管理中心意见,我中心形成了《医疗器械产品适用强制性标准清单》(以下简称“清单”)。现就清单的使用作如下说明: ……
增材制造椎间融合器注册审查指导原则
2022-11-17
增材制造椎间融合器注册审查指导原则 本指导原则旨在指导注册申请人对增材制造椎间融合器注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的审评提供参考。 本指导原则是对增材制造椎间融合器注册申报资料的一般要求,申请人需依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依……
中国血压计产品与市场分析
2022-11-16
2022年11月,最新的《中国高血压临床实践指南》发布,让很多人一夜之间进入了高血压的行列。 该指南由国家心血管病中心、中国医师协会等高血压领域专家研究制定。指南推荐将我国成人高血压诊断界值下调为收缩压≥130mmHg,舒张压≥80mmHg。这意味着,长期以来140/90mmHg才被诊断为高血压的时代,已经成为了……