盘点医疗器械标签的要求
2023-05-12
提起“医疗器械标签”,总有“最熟悉的陌生人”的既视感,熟悉是因为它司空见惯、无处不在,陌生是因为它的重要性经常被忽视,医疗器械生产经营企业或使用者往往更注重器械的质量控制,却轻视了医疗器械标签的规定。 其实,医疗器械标签是展现医疗器械安全性、有效性、主要技术特征等信息的重要载体,未规范标注标签可能为医疗器……
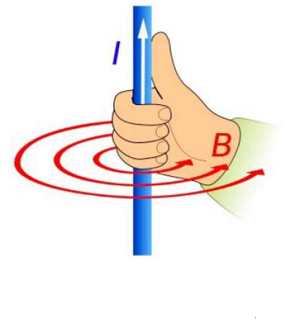
振动试验机的动作原理和构造
2023-05-12
振动试验机的动作原理和构造 电动型振动试验机的基本构造和音响的喇叭类似,只是喇叭的发音部分变成了金属制(铝合金或镁合金)的动圈,动圈受力发生上下振动。 其原理是高中时学的左手定则,磁场中的导体通电产生力,可通过下式表示。 B的产生利用右手法则,即电流流过导体,其……
医疗器械注册质量管理体系考核回答问题注意事项
2023-05-10
在医疗器械注册质量管理体系考核时,并非话越多越好,也不是话少就好,语言是一门艺术,沟通是需要技巧和方法。医疗器械注册人在准备体考时,也要提前准备好,特别是如下事项: 1.一定要提前指定好由谁回答检查员问题,最好全程有一位经验丰富的领导陪同。 2.未在文件中规定而进行操作和管理的内容,尽量不要……
电源端子骚扰电压试验项目
2023-05-10
电源端子骚扰电压试验项目俗称:传导干扰、传导发射、传导骚扰、电信端口发射试验等。 传导发射(Conducted Emission)试验简称CE,也被叫做传导骚扰、传导干扰、电源端子骚扰电压,传导发射是指系统内部的电压或电流通过信号线、电源线或者地线传输出去而成为其他系统或设备干扰源的一种电磁现象。传导发射测试也叫……
车载设备GBT24338.4-2018标准电磁兼容测试项目要点
2023-05-09
车载设备GB/T24338.4-2018标准电磁兼容测试同样也是考核受试产品电磁兼容两个方面的检测项目,一方面是抗干扰试验EMS类,一个是发射试验EMI部分。 一、电磁兼容抗扰度试验EMS项目: 1、机箱端口抗扰度试验: 射频电磁场辐射、射频电磁场数字通信装置抗扰度、静电放电试验; 2、……
31项医疗仪器强制性国家标准于5月1日起实施
2023-05-08
31项医疗仪器强制性国家标准于5月1日起实施,分别是: 1、GB 9706.1-2020医用电气设备 第1部分:基本安全和基本性能的通用要求; 2、GB 9706.212-2020医用电气设备 第2-12部分:重症护理呼吸机的基本安全和基本性能专用要求; 3、GB 9706.237-2020医用电气……
无源医疗器械注册单元划分与实例
2023-05-08
2017年GJ药监局发布了《医疗器械注册单元划分指导原则》该导则提到,注册单元划分着重考虑产品的技术原理、结构组成、性能指标、适用范围及体外诊断试剂的包装规格等因素。 该导则还包含了有源医疗器械、无源医疗器械及体外诊断试剂注册单元划分的指导原则,并列举了有关注册单元划分的实例。 以下是无源医……
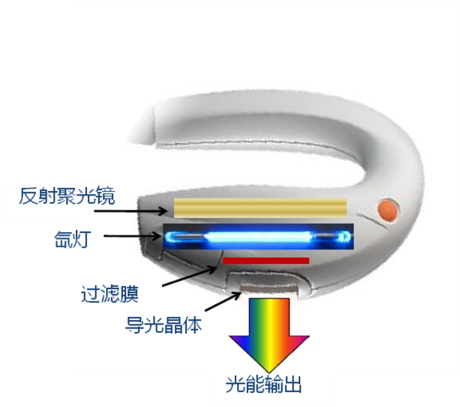
《强脉冲光治疗设备注册审查指导原则(2023年修订版)》正式发布(附全文)
2023-05-06
刚刚,GJ药监局器审中心发布《强脉冲光治疗设备注册审查指导原则(2023年修订版)》,内容如下: 强脉冲光治疗设备注册审查指导原则(2023年修订版) 本指导原则旨在指导注册申请人规范强脉冲光治疗设备研制过程、准备及撰写医疗器械注册申报资料,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是……
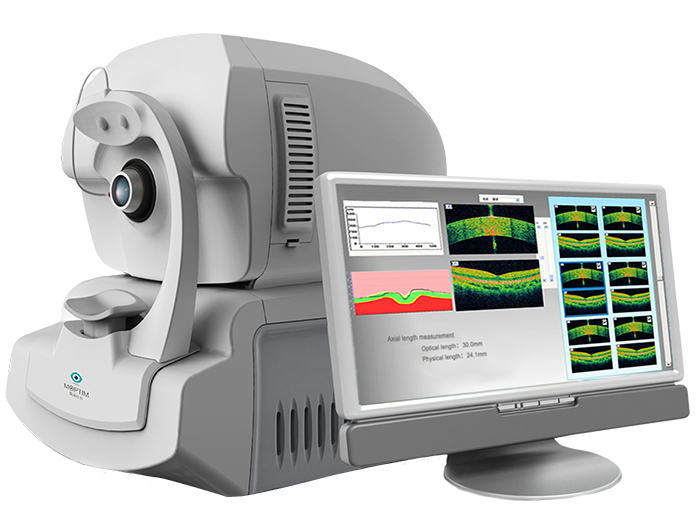
《眼科光学测量设备注册审查指导原则》正式发布(附全文)
2023-05-06
刚刚,GJ药监局器审中心发布《眼科光学测量设备注册审查指导原则》,内容如下: 眼科光学测量设备注册审查指导原则 本指导原则旨在为技术审评部门审评眼科光学测量设备注册申报资料提供参考,同时也用于指导注册申请人对申报资料的准备及撰写。 本指导原则是对眼科光学测量设备的一般要求,注册申请人应依据产品的具体特……
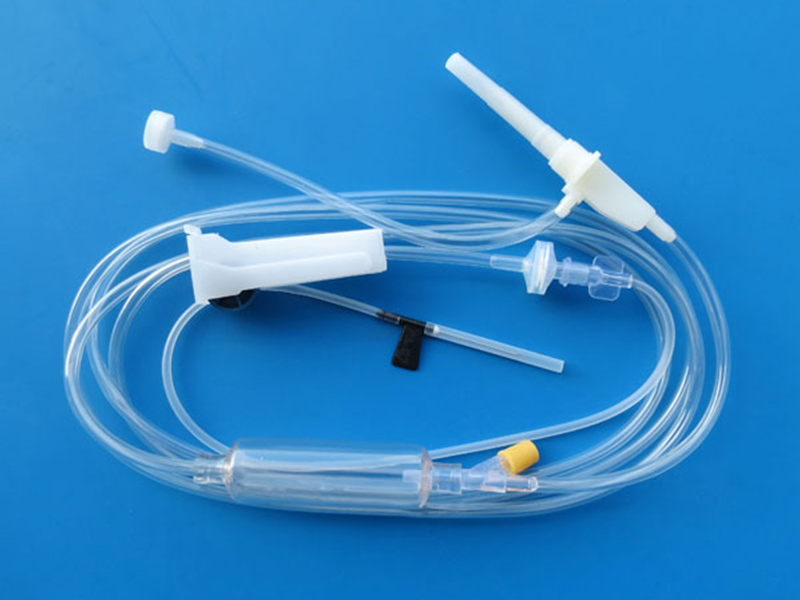
《一次性使用避光输液器注册审查指导原则(2023年修订版)》正式发布(附全文)
2023-05-05
刚刚,GJ药监局器审中心发布《一次性使用避光输液器注册审查指导原则(2023年修订版)》,内容如下: 一次性使用避光输液器注册审查指导原则(2023年修订版) 本指导原则旨在帮助和指导注册申请人对一次性使用避光输液器(以下简称避光输液器)产品注册申报资料进行准备,同时也为技术审评部门提供参考。 本指导……
《一次性使用输注器具产品注册审查指导原则(2023年修订版)》正式发布(附全文)
2023-05-05
刚刚,GJ药监局器审中心发布《一次性使用输注器具产品注册审查指导原则(2023年修订版)》,内容如下: 一次性使用输注器具产品注册审查指导原则(2023年修订版) 本指导原则旨在帮助和指导注册申请人对一次性输注器具产品注册申报资料进行准备,同时也为技术审评部门提供参考。 本指导原则是对一次性使用输注器……
《一次性使用血液分离器具注册审查指导原则(2023年修订版)》正式发布(附全文)
2023-05-05
刚刚,GJ药监局器审中心发布《一次性使用血液分离器具注册审查指导原则(2023年修订版)》,内容如下: 一次性使用血液分离器具注册审查指导原则(2023年修订版) 本指导原则旨在帮助和指导注册申请人对一次性使用血液分离器具产品注册申报资料进行准备,同时也为技术审评部门提供参考。 本指导原则是对一次性使……