《血液透析器注册审查指导原则(2023年修订版)》正式发布(附全文)
2023-05-05
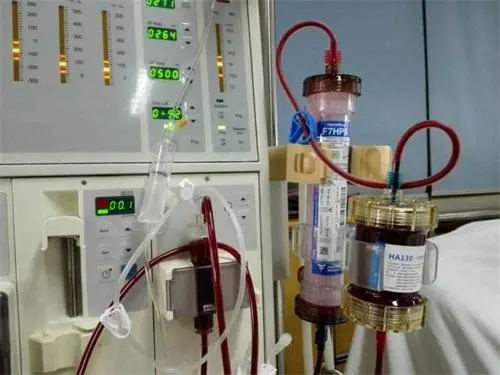
刚刚,GJ药监局器审中心发布《血液透析器注册审查指导原则(2023年修订版)》,内容如下: 血液透析器注册审查指导原则(2023年修订版) 本指导原则旨在指导注册申请人对血液透析器(以下简称透析器)注册申报资料的准备及撰写,同时也为技术审评部门提供参考。 本指导原则是对透析器的一般要求,注册申请人应依……
《血液透析浓缩物注册审查指导原则(2023年修订版)》正式发布(附全文)
2023-05-05
刚刚,GJ药监局器审中心发布《血液透析浓缩物注册审查指导原则(2023年修订版)》,内容如下: 血液透析浓缩物注册审查指导原则(2023年修订版) 本指导原则旨在指导注册申请人对血液透析浓缩物(以下简称浓缩物)注册申报资料的准备及撰写,同时也为技术审评部门提供参考。 本指导原则系对浓缩……
CBCT图像为何比CT图像“模糊”及CBCT常见体膜介绍
2023-05-05
CBCT(锥形束CT)是影像引导放疗比较常见的一种实现方式,在将CBCT图像与CT图像进行配准比较时,需要区分出哪个是CBCT图像、哪个是CT图像,Delta德尔塔仪器小编习惯的做法是观察图像的清晰度,结构更为清晰(更为细腻)的是CT图像。 对于CBCT图像比较模糊的原因,Delta德尔塔仪器小编总结了一下原因: 从CBCT的实现原理和结构组成来说,CBCT借助的是锥形束,与CT的扇形束相比,这种方式的散射线相对更多,而且X线球管到探测器的距离更远,就像是扫描孔径更大。 从探测器上来说,
《一次性使用引流管产品注册审查指导原则(2023年修订版)》公开征求意见 (附全文)
2023-05-04
刚刚,GJ药品监督管理局医疗器械技术审评中心发布《一次性使用引流管产品注册审查指导原则(2023年修订版)》,内容如下: 一次性使用引流管产品注册审查指导原则(2023年修订版) 本指导原则旨在帮助和指导注册申请人对一次性使用引流管注册申报资料的准备及撰写,同时也为医疗器械技术审评部门对注册申报资料的技术审……
《一次性使用鼻氧管注册审查指导原则(2023年修订版)》公开征求意见(附全文)
2023-05-04
刚刚,GJ药品监督管理局医疗器械技术审评中心发布《一次性使用鼻氧管注册审查指导原则(2023年修订版)》,内容如下: 一次性使用鼻氧管注册审查指导原则(2023年修订版) 本指导原则旨在帮助和指导注册申请人对一次性使用鼻氧管注册申报资料的准备及撰写,同时也为医疗器械技术审评部门对注册申报资料……
医疗设备电源的要求与特点
2023-05-04
一台医疗设备在医院是否能够发挥其最大效能,除了与机器本身的技术性能有直接的关系外,还和供电电源的质量有着极其重要的关系。电源品质的好坏,将直接影响医疗设备的运行稳定性和可靠性,甚至导致重大医疗设备事故和造成巨大的经济损失。 目前,国内的医疗设备大多采用220V市电供电。由于各种不同类型的医疗设备供电……
中国医疗器械行业发展基础薄弱,严重依赖进口
2023-05-04
在产业升级、进口替代、人口结构变化和医改等诸多基本面因素的影响下,中国医疗器械行业保持了较快的发展速度,大大超越了全球医疗器械产业5%左右的增长。但是无论从中国医疗器械产业占全球的比例或是医疗器械上市企业的市值规模来看,中国医疗器械产业与世界先进水平的差距是明显的。 虽然中国医疗器械上市企业的规模还偏小,……
《手术动力设备注册审查指导原则(2023年修订版)》公开征求意见(附全文)
2023-04-28
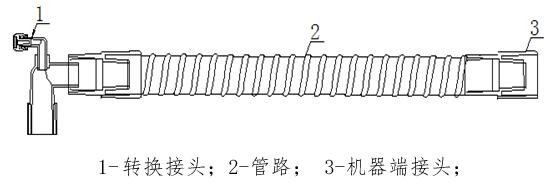
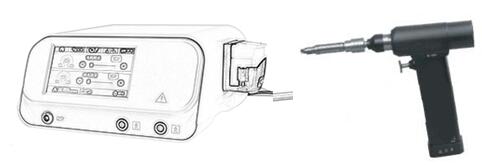
刚刚,GJ药品监督管理局医疗器械技术审评中心发布《手术动力设备注册审查指导原则(2023年修订版)》,内容如下: 手术动力设备注册审查指导原则(2023年修订版) 本指导原则旨在指导注册申请人对手术动力设备注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对手术动力……