推进质谱临床检测方法标准化体系建设
2022-09-13
如果要细数体外诊断应用领域的热点都有哪些?质谱必须算一个。 质谱技术凭借高特异性、高灵敏度、可实现多组分同时检测等特点,目前已经在新生儿遗传代谢病筛查、维生素检测、类固醇类激素、治疗药物监测、毒物筛查等多个临床应用场景发挥作用。 Joseph John Thomson发明。由……
创新医疗器械审查常见问题答疑
2022-09-13
一、《创新医疗器械特别审查程序》出台的背景是什么? 为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》、国务院《关于改革药品医疗器械审评审批制度的意见》,鼓励医疗器械研发创新,促进医疗器械新技术的推广和应用,深化供给侧结构性改革和“放管服”改革要求,推动医疗器械产……
首个FDA批准的牙科手术导航机器人Yomi
2022-09-13
手术机器人,作为技术含量高的大型治疗设备,近年受到医院和医生们的认可。作为消费医疗属性的牙科、眼科,也有了更多的机器人解决方案。 牙科市场潜力大,根据国内机构研究显示:我国口腔种植牙市场需求正在快速增长,2020年我国口腔种植牙需求量达到210万颗以上,尤其是在国内老龄化加剧以及饮食习惯改变,对于种植牙需……
无菌医疗器械的理化试验项目及要求
2022-09-09
为确保无菌医疗器械的质量以及临床医疗使用的安全、有效,必须对其生产过程中的原料选择、配方、工艺流程、最终成品等进行一些检测,以用于生产工艺过程的监控及最终产品的放行。本文整理了无菌医疗器械的理化检测项目的要求供大家参考及自查。 ……
液相色谱串联质谱系统注册审查指导原则征求意见(附全文)
2022-09-06
刚刚,国家药监局器审中心发布《液相色谱串联质谱系统注册审查指导原则》征求意见稿,全文如下: 液相色谱串联质谱系统注册审查指导原则 本指导原则旨在指导注册申请人对液相色谱串联质谱系统注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是对液相色谱串联质谱系……
电子上消化道内窥镜注册技术审查指导原则
2022-09-06
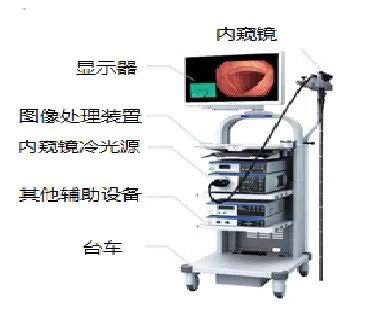
电子上消化道内窥镜注册技术审查指导原则 本指导原则旨在为技术审评部门审评注册申报资料提供参考,同时也用于指导申请人对电子上消化道内窥镜(本文中简称为内窥镜)注册申报资料的准备及撰写。 本指导原则是对电子上消化道内窥镜的一般要求,审评人员和申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需申请人具体……
手术机器人技术与专利分析
2022-09-05
前言 手术机器人是一种先进的医疗设备,借助微创伤手术及相关底层技术的发展而发明。手术机器人是医疗机器人的一种细分领域。手术机器人,即外科医生能够通过远程控制,并通过微小切口精密操作进入患者体内的手术器械,从而辅助外科医生进行微创手术的精密操作型机器人。 手术机器人被用于在高于人类能力的微创伤……
美国FDA监管科学研究进展及启示
2022-09-05
2017 年 6 月,我国正式成为国际人用药品注册技术协调会(ICH)成员,这意味着我国药品注册管理与国际接轨,药品研发和注册进入全球化时代;2021 年 6 月国家药品监督管理局(简称“国家药监局”)成功连任 ICH 管理委员会成员,我国药品监管大踏步走向国际舞台[1]。随着药品审评审批制度改革的不断深化,药品监管理……
一文读懂美国医疗器械产业的结构与特点
2022-09-02
01全球医疗器械产业发展概述 医疗器械是生命健康产业最重要的子领域之一,是精密制造与精准医疗渗透、单点创新与集成创新融合的典型代表,上游行业技术进步亦能推动医疗设备产品革新,医疗设备的创新发展对培育壮大生命健康产业新能动至关重要。 目前美国是世界上大的医疗器械市场和先进医疗技术的主导国,占全……
医疗器械生物相容性相关问题答疑
2022-09-02
问1、慢性和遗传毒性测试可以通过化学表征来替代吗? 答:慢性毒性试验和遗传毒性试验,如果化学表征和已有的文献资料能够覆盖其风险,则慢性毒性和遗传毒性试验可以豁免。 问2、永久植入类产品需要做致癌性测试吗?如果是临床常用材料,是否可以豁免? 答:按照GB/T16886.1-2022《附录A 生物……
医疗器械临床试验方案中考虑的要点和常见问题
2022-09-01
临床试验方案的起草和制订始于科学和医学问题,止于综合而全面的研究计划,使之成为可以验证临床假设的切实可行的试验。一个编写良好的方案如果按计划实施,不仅应该可以回答所提出的科学和医学问题,而且在试验方案的实施过程中还应该包括不同的意外处理预案,以处理和解决各种无法预料或非预期的情况和问题。因此,这是一个具有挑战性和复杂的……
一次性使用血液分离器具注册审查指导原则修订征求意见(附全文)
2022-09-01
一次性使用血液分离器具注册审查指导原则 (2022年修订版)(征求意见稿) 本指导原则旨在帮助和指导注册申请人对一次性使用血液分离器具产品注册申报资料进行准备,同时也为技术审评部门提供参考。 本指导原则是对一次性使用血液分离器具产品注册申报资料的一般要求,注册申请人可依据具体产品的特性……