如何确保医疗器械的安全有效?
2022-08-30
什么是医疗器械的安全有效? 在国际医疗器械监管机构论坛《医疗器械和体外诊断试剂医疗器械安全和性能基本原则》文件中[IMDRF “Essential Principles of Safety and Performance of Medical Devices and IVD Med……
美国突破性医疗器械认定要求
2022-08-29
什么是突破性器械 突破性器械程序Breakthrough Devices Program(2015年被称为加速入市途径EAP,2018年被FDA修订为突破性器械程序)是一个由申请人自愿向FDA递交的申请,此程序适用于那些为治疗或诊断危害生命或不可逆转的使人衰弱的疾病所急需的医疗器械和以器械为主导的组合产品……
我国医疗器械注册自检管理工作进展及展望
2022-08-29
医疗器械设计验证是医疗器械设计开发的重要阶段,注册申请人为了确保设计开发的输出能够满足输入要求,必须对设计开发进行验证,而产品检验是相应验证的重要方法,因此在注册时必须要提交产品检验报告,从而更好地对产品进行评价。 2000年、2014年和2017年3版《医疗器械监督管理条例》中,明确注册申请人在注册时提交的产品……
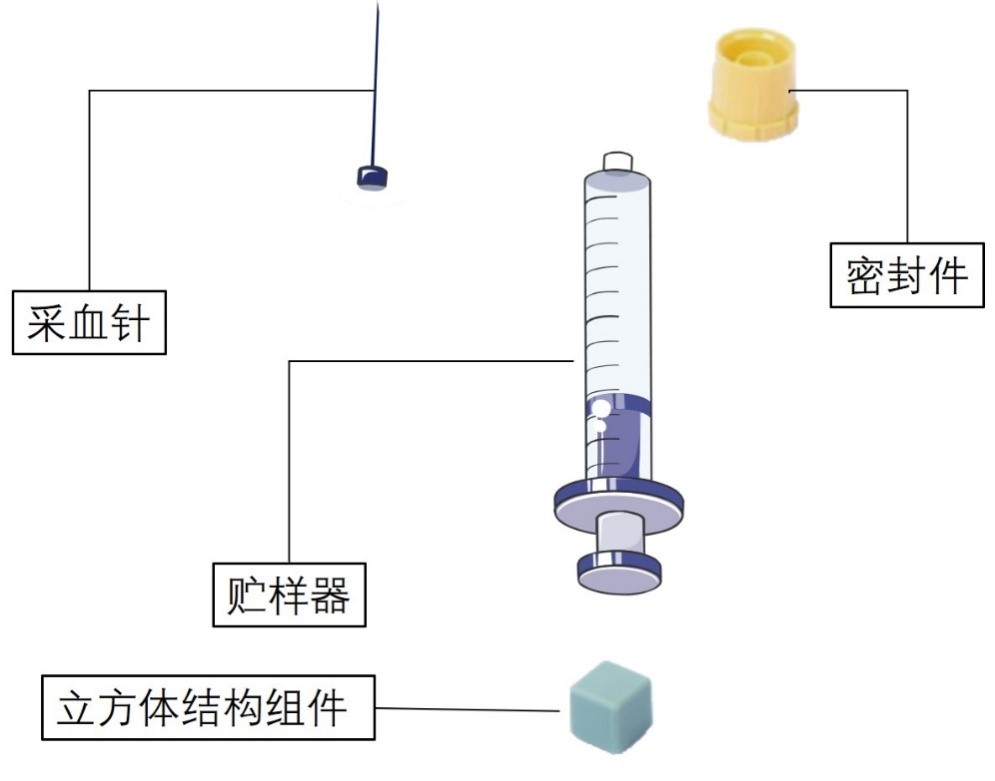
一次性使用人体动脉血样采集器注册审查指导原则征求意见(附全文)
2022-08-27
刚刚,中国器审发布《一次性使用人体动脉血样采集器注册审查指导原则(征求意见稿)》,全文如下: 一次性使用人体动脉血样采集器注册审查指导原则(征求意见稿) 本指导原则旨在帮助和指导注册申请人对一次性使用人体动脉血样采集器产品的注册申报资料进行准备,以满足技术审评的基本要求。同时有助于审评机构对……
经皮肠营养导管注册审查指导原则征求意见(附全文)
2022-08-27
刚刚,中国器审发布《经皮肠营养导管注册审查指导原则(征求意见稿)》,全文如下: 经皮肠营养导管注册审查指导原则 (征求意见稿) 本指导原则旨在帮助和指导注册申请人对经皮肠营养导管产品的注册申报资料进行准备,以满足技术审评的基本要求。同时有助于审评机构对该类产品进行科学规范的审评,提高审……
射频美容设备注册审查指导原则 (征求意见稿)
2022-08-26
射频美容设备注册审查指导原则 (征求意见稿) 本指导原则旨在指导注册申请人对射频美容设备注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对射频美容设备的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依……
定量检测体外诊断试剂分析性能评估注册审查指导原则
2022-08-26
附件 定量检测体外诊断试剂分析性能评估注册审查指导原则 分析性能评估资料是评价产品安全有效性的重要支持性资料之一。科学合理地开展产品的分析性能评估,确定产品的各项分析性能指标,是产品设计开发的关键过程。本指导原则旨在指导注册申请……
医疗器械包装技术知识汇总
2022-08-25
医疗包装是指对医疗器械的初包装,可对其进行灭菌,可进行无菌操作(如洁净开启),能提供可接受的微生物阻隔性能,灭菌前后能对产品进行保护并且灭菌后能在一定期限内(标注的有效期)维持系统内部无菌环境的包装系统。 医疗器械包装设计与管理,你遇到过多少难题 可适合的灭菌方式:ETO环氧乙烷、高温湿热蒸……
我国主导的IEEE人工智能医疗器械全球标准发布
2022-08-25
7月1日,中国食品药品检定研究院(以下简称中检院)牵头的电气电子工程师学会(IEEE)人工智能医疗器械标准工作组起草的IEEE 2801—2022(医学人工智能数据集质量管理推荐标准)正式发布,成为人工智能医疗器械领域的首个全球性标准。 该国际标准由中检院提出,于2018年12月正式获批立项。该标准的起草过程展现……