血管夹产品注册审查指导原则发布
2022-09-20
血管夹产品注册审查指导原则 本指导原则旨在提供系统规范的指南性文件,用于指导注册申请人进行注册申报,同时也为技术审评部门提供技术指导。 本指导原则是对血管夹产品注册申报资料的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化。申请人还应依据具体产品的特性确定其中的具体内容是否适用,若不适……
ISO13485和GMP对医疗器械成品检验的要求
2022-09-20
开篇,我们来重温一下检验的概念。 检验的定义来自于GB/T 19000-2008《质量管理体系基础和术语》:检验是通过观察和判断,适当时结合测量、试验或估量所进行的符合性评价。 相信大部分质量法规人员,都知道全面质量管理的概念,即TQM(Total Quality Management),就……
医疗器械从研发到上市的流程、时间和费用预算介绍
2022-09-19
一、质量体系建立 1、法规背景 为了保障医疗器械产品的安全有效,加强对医疗器械的监督管理,提升企业质量管理水平,医疗器械生产企业需严格按照法规要求建立质量管理体系。涉及的相关标准如下: 1《医疗器械监督管理条例》(国务院令第739号) 2《医疗器械注册与备案管理办法》(总局令第4……
一文读懂医疗器械CE认证!
2022-09-16
01欧洲CE认证简介 根据MedTec Europe统计,2022年欧洲医疗器械市场规模约为1350亿欧元,约占全球市场的27%,是仅次于美国的第二大医疗器械市场。 自2021年5月起,医疗器械制……
2022年上半年手术机器人市场排行榜单重磅发布!
2022-09-16
7月份,我们发布2021年手术机器人市场排行榜,引起众多媒体企业广泛关注,并引发了行业关于手术机器人赛道发展的多方热烈讨论。 从行业领域本身来说,手术机器人研发囊括了医学、工程学、生物力学、机械力学、材料学、计算机图形学、计算机视觉、数学分析等诸多学科,可以说是集万千“新技术”为一体的新型交叉研究领域,为医疗器械……
有源设备执行新《医疗器械产品技术要求编写指导原则》的一些注意事项
2022-09-15
新的《医疗器械产品技术要求编写指导原则》已于2022年2月8日发布,部分内容看似新增,实际上,在新的《医疗器械产品技术要求编写指导原则》发布之前,伴随着各个法规、部门规章等文件的实施,相关要求已经开始执行。 下面对和有源产品相关的,涉及到变化部分且咨询内容比较多的内容,提醒相关注意事项: 1……
医美定制化需求成为医疗3D打印新增长点
2022-09-15
近年来,医疗3D打印技术已取得一定的发展,被广泛地应用于多个领域。随着3D打印技术在医疗领域的优势日益突出,国家也出台了一系列政策支持医疗3D打印的发展,例如“十四五”规划将3D打印列入国家重点研发计划。今年4月,国家药监局发布了《增材制造聚醚醚酮植入物注册技术审查指导原则(征求意见稿)》,规范了3D打印(增材制造)相……
各类呼吸机适用标准与技术要求
2022-09-14
本文以市面上常见的呼吸机为讨论对象,介绍其对应的标准以及在评估标准时,需要考虑到的风险。 Part 1呼吸机的分类 呼吸机的分类方法有两种: 01按照使用的环境进行分类 按照使用环境,可以将呼吸机大致分为以下三类: ① 专业健康设施环境下使用的呼吸机……
眼科光学测量设备注册审查指导原则 (征求意见稿)
2022-09-13
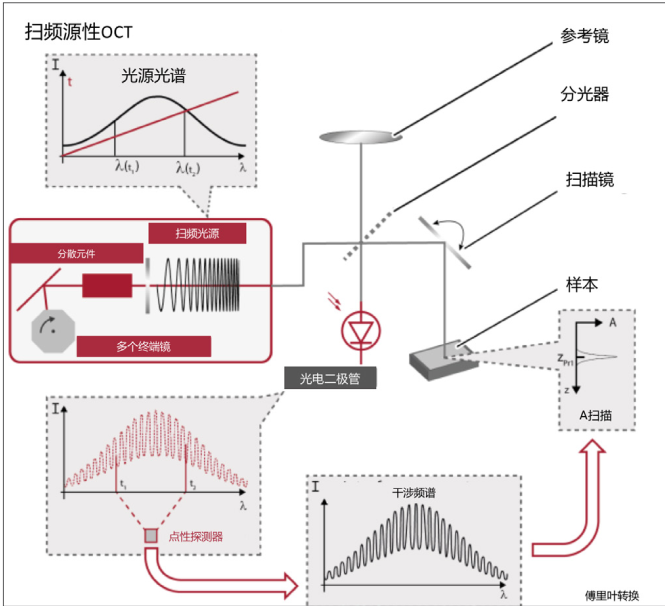
眼科光学测量设备注册审查指导原则 (征求意见稿) 本指导原则旨在为技术审评部门审评眼科光学测量设备注册申报资料提供参考,同时也用于指导注册申请人对申报资料的准备及撰写。 本指导原则是对眼科光学测量设备的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依……