记忆合金肋骨板注册审查指导原则 (征求意见稿)
2024-11-28
记忆合金肋骨板注册审查指导原则(征求意见稿) 本指导原则旨在指导注册申请人对记忆合金肋骨板注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的审评提供参考。 本指导原则是对记忆合金肋骨板注册申报资料的一般要求,注册申请人需依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相……
牙科树脂类充填材料产品注册审查指导原则 (2024年修订版) 征求意见稿
2024-11-28
牙科树脂类充填材料产品注册审查指导原则(2024年修订版)征求意见稿 本指导原则旨在指导注册申请人对牙科树脂类充填材料产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的审评提供技术参考。 本指导原则是对牙科树脂类充填材料产品注册申报资料的一般要求,注册申请人需依据产品的具体特性确定其……
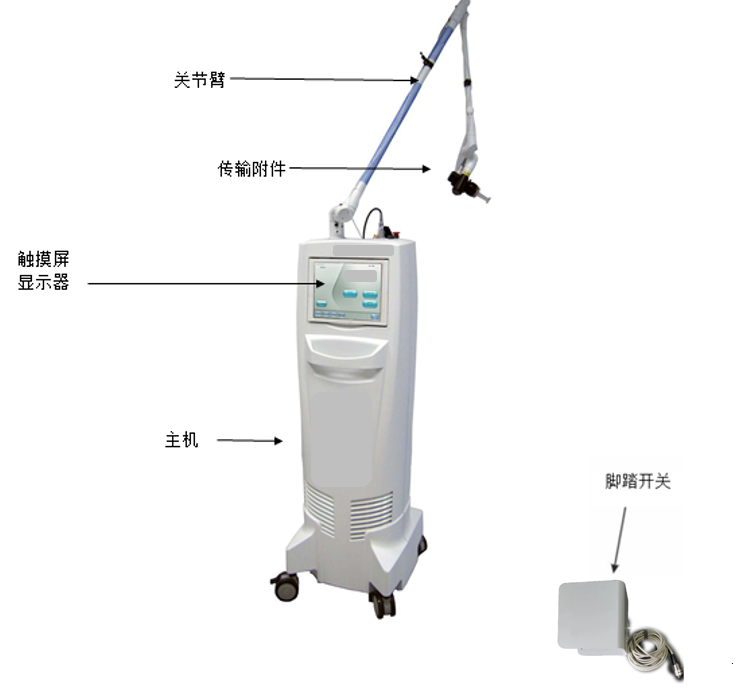
二氧化碳激光治疗设备注册审查指导原则 (征求意见稿)
2024-11-28
二氧化碳激光治疗设备注册审查指导原则(征求意见稿) 本指导原则旨在指导注册申请人对二氧化碳激光治疗设备注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是对二氧化碳激光治疗设备的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应……
有源医疗器械荧光成像性能评估注册审查指导原则(征求意见稿)
2024-11-28
有源医疗器械荧光成像性能评估注册审查指导原则(征求意见稿) 具备荧光成像功能的有源医疗器械通常需要配合已上市的荧光造影剂共同使用,对于荧光成像的性能评估是评价产品安全性有效性的重要支持性资料之一。本指导原则旨在指导注册申请人科学合理地对有源医疗器械荧光成像功能进行定量评估,并整理形成注册申报资料,同时也为技术审评……
超声洁牙设备注册审查指导原则(2024年修订版)征求意见(附全文)
2024-11-25
超声洁牙设备注册审查指导原则(2024年修订版)(征求意见稿) 本指导原则旨在指导注册申请人对超声洁牙设备注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是对超声洁牙设备产品的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应……
超声骨密度仪注册审查指导原则(2024年修订版)征求意见(附全文)
2024-11-25
超声骨密度仪注册审查指导原则(2024年修订版)(征求意见稿) 本指导原则旨在为注册申请人进行超声骨密度仪产品的注册申报提供技术指导,同时也为医疗器械监督管理部门对注册申报资料的审评提供技术参考。 本指导原则是对超声骨密度仪的一般要求,注册申请人需依据产品的具体特性确定其中内容是否适用,若不适用,需……
超声理疗设备注册审查指导原则(2024年修订版)征求意见(附全文)
2024-11-22
超声理疗设备注册审查指导原则(2024年修订版)(征求意见稿) 本指导原则旨在指导注册申请人对超声理疗设备注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对超声理疗设备的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科……
超声多普勒胎儿监护仪注册审查指导原则(2024年修订版)征求意见(附全文)
2024-11-22
超声多普勒胎儿监护仪注册审查指导原则(2024年修订版)(征求意见稿) 本指导原则旨在指导注册申请人对超声多普勒胎儿监护仪注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是对超声多普勒胎儿监护仪的一般要求,申请人应依据产品的具体特性确定其中的内容是否适用。若不适用……
超声多普勒胎儿心率仪注册审查指导原则(2024年修订版)征求意见(附全文)
2024-11-19
超声多普勒胎儿心率仪注册审查指导原则(2024年修订版)(征求意见稿) 本指导原则旨在指导注册申请人对超声多普勒胎儿心率仪注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是对超声多普勒胎儿心率仪的一般要求,申请人应依据产品的具体特性确定其中的内容是否适用。若不适用……
输液泵注册审查指导原则(2024年修订版)征求意见(附全文)
2024-11-19
输液泵注册审查指导原则(2024年修订版)(征求意见稿) 本指导原则旨在为技术审评部门审评输液泵注册申报资料提供参考,同时也用于指导注册申请人对申报资料的准备及撰写。 本指导原则是对输液泵的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据……
电动轮椅车注册审查指导原则(2024年修订版)征求意见(附全文)
2024-11-19
电动轮椅车注册审查指导原则(2024年修订版)(征求意见稿) 本指导原则旨在为技术审评部门审评电动轮椅车注册申报资料提供参考,同时也用于指导注册申请人对申报资料的准备及撰写。 本指导原则是对电动轮椅车的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学……
手术无影灯注册审查指导原则(2024年修订版)征求意见(附全文)
2024-11-19
手术无影灯注册审查指导原则(2024年修订版)(征求意见稿) 本指导原则旨在指导和规范手术无影灯的注册申报工作,帮助申请人理解和掌握该类产品的原理、结构、主要风险、性能、预期用途等内容,用来指导申请人准备和撰写申报资料。同时也可以用于帮助审评人员把握技术审评工作基本要求和尺度,对产品安全性、有效性做出系统……