一文看懂医疗器械从研发到上市的那些事儿!
2025-03-31
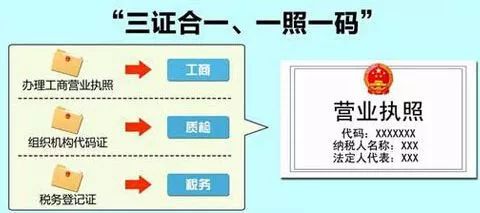
工商注册 现如今,公司实行注册资本认缴制和三证合一登记制度,注册流程大为简化,注册费用大为节约,注册周期也大为缩减。 但在公司注册前,需认真思考经营范围,前置考虑未来产品生产范围,避免后续再做变更。 产品开发设计 产品设计开发可分7个阶段:策划阶段、设计输……
静电放电测试标准GB 17626.2深度解读
2025-03-28
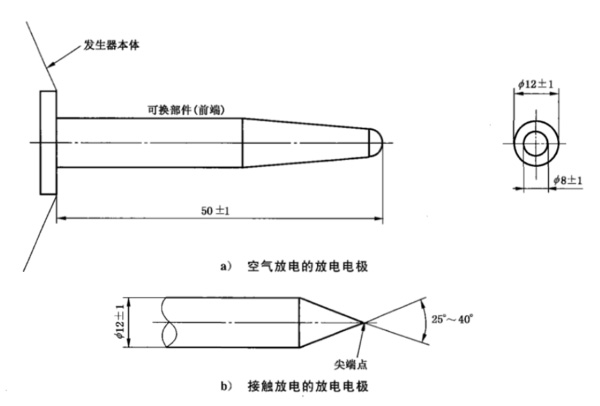
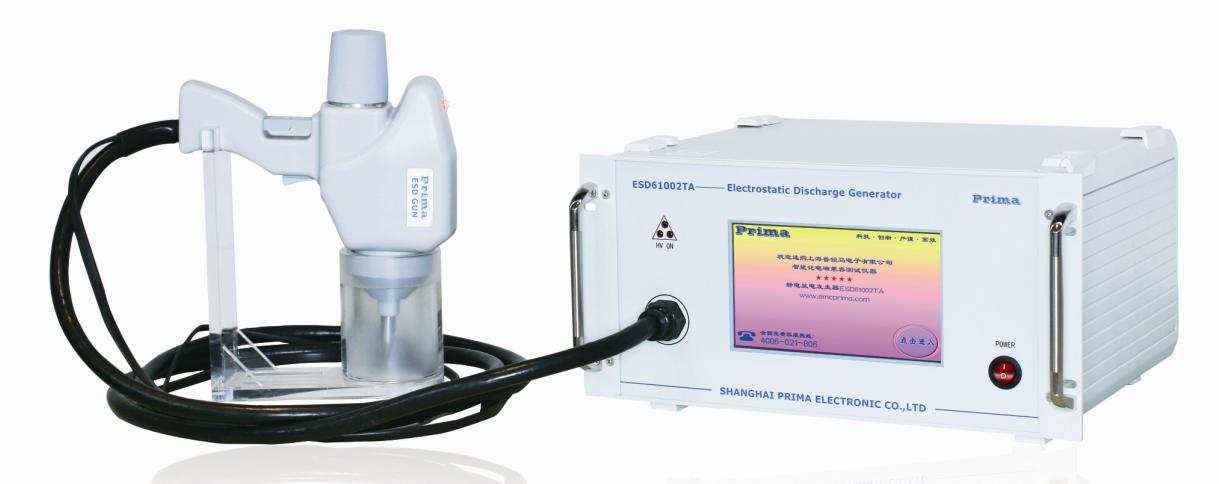
做产品的硬件设计有没有必要了解静电抗扰度试验测试方法的一些要点?答案是非常有必要。以空气放电与接触放电方法为例,两种测试方法的干扰主要方式不同,并且对同一产品的不同地方进行测试,标准里都有明确的要求。而在产品的结构与硬件设计过程中,便可以结合静电测试方法针对性的给出最优方案。这也便是知己知彼,方能百战不贻。本文详细解读……
热敷贴(袋)的产品注册方案及温度特性测试仪
2025-03-14
热敷贴(袋)是一种外用物理治疗器械,通过铁粉氧化反应产生热量,以热传导方式作用于人体局部,促进血液循环,辅助消炎、消肿和止痛。其核心发热材料不含药物成分,符合Ⅱ类医疗器械管理要求。为确保产品性能稳定,需结合YY0060-2018等标准,通过专用测试设备(如热敷贴温度特性测试仪)进行严格质量控制。 ……
超声前沿︱水听器的必备知识!你知道吗?
2025-03-13
水听器特别特别特别“金贵”特别特别“精密”,往往一碰就无法修复,10多万就打水漂了。那么……在做“正常”的测量,水听器会被损坏吗?水听器有很多类型,有膜式、胶囊式、探针,以及光纤式,如何选择呢?水听器,都必须经过校准吗?实验用水通常需要经过过滤和去离子处理,还有除气,这又是为什么呢?想知道答案,本期我们一起来学习生物医……
常见放射诊疗设备检测项目汇总
2025-03-07
《放射射诊疗管理规定》(卫生部令第46号,2006年3月1日施行;G家卫生和计划生育委员会令第8号,2016年1月19日修订)等法规对放射诊疗设备的质量控制检测提出明确要求。 而在WS 76-2020 《医用X射线诊断设备质量控制检测规范》等技术规范中对验收检测、状态检测、稳定性检测的定义、周期、检测机构……
静电放电发生器静电效应及其作用规律
2025-03-06
一、静电力学效应: 静电放电发生器静电带电体周围有静电场。由于静电场在正常情况下不均匀,静电场极化的介质颗粒会受到电场力的影响,受力方向指向带电体。也就是说,无论带电体有什么极性电荷,带电体都会吸引原来没有带电的灰尘颗粒。因此,悬浮在空气中的灰尘容易被物体吸附,造成污染。在半导体设备生产车间,如果半导体芯……
医疗器械包装加速老化实验的方法、要求与注意事项
2025-03-06
医疗器械包装的加速老化实验是确保包装在储存和使用过程中保持完整性和功能性的重要手段。通过加速老化实验,可以快速评估包装材料在长时间储存和环境条件下的性能变化,从而支持医疗器械包装的有效期声明。本文将介绍加速老化实验的方法、要求及注意事项。 一、加速老化实验的基本原理 加速老化实验通过将样品在……
种植用口腔骨填充材料注册审查指导原则(征求意见稿)
2024-12-03
种植用口腔骨填充材料注册审查指导原则(征求意见稿) 本指导原则旨在指导注册申请人对种植用口腔骨填充材料注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的审评提供技术参考。 本指导原则是对种植用口腔骨填充材料注册申报资料的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用。若不适……
胸骨捆扎固定系统注册审查指导原则 (征求意见稿)
2024-12-03
胸骨捆扎固定系统注册审查指导原则(征求意见稿) 本指导原则旨在指导注册申请人对胸骨捆扎固定系统注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的审评提供参考。 本指导原则是对胸骨捆扎固定系统注册申报资料的一般要求,注册申请人需依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理……
颅骨修补网板系统注册审查指导原则 (征求意见稿)
2024-12-02
颅骨修补网板系统注册审查指导原则(征求意见稿) 本指导原则旨在指导注册申请人对颅骨修补网板系统注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的审评提供参考。 本指导原则是对颅骨修补网板系统注册申报资料的一般要求,注册申请人需依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理……