牵引床注册审查指导原则征求意见(附全文)
2024-11-08
牵引床注册审查指导原则(征求意见稿) 本指导原则旨在指导注册申请人对牵引床注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是对牵引床注册申报资料的一般要求,申请人应依据产品的具体特性确定其中的内容是否适用。若不适用,需具体阐述其理由及相应的科学依据,并依据具体的产……
医用中心吸引系统注册审查指导原则征求意见(附全文)
2024-11-08
医用中心吸引系统注册审查指导原则(征求意见稿) 本指导原则旨在指导注册申请人对医用中心吸引系统注册申报资料的准备及撰写,同时也为技术审评部门提供参考。 本指导原则是对医用中心吸引系统的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的……
家用无创呼吸机(非生命支持)注册审查指导原则征求意见(附全文)
2024-11-05
家用无创呼吸机(非生命支持)注册审查指导原则(征求意见稿) 本指导原则旨在指导注册申请人对家用无创呼吸机(非生命支持)注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对家用无创呼吸机(非生命支持)的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适……
电子听诊器注册审查指导原则征求意见(附全文)
2024-11-05
电子听诊器注册审查指导原则(征求意见稿) 本指导原则旨在指导注册申请人对电子听诊器注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对电子听诊器的一般要求,申请人应依据产品的具体特性确定其中内……
牙科种植体(系统)研发实验要求与主要风险
2024-11-04
本文适用于经外科手术后保留于口腔软硬组织内的牙科种植体(系统)。 牙科种植体(系统)一般用于通过外科手术方式将产品植入人体缺牙部位的上下颌牙槽骨内,用于为义齿等修复体提供固定或支撑,以恢复患者的咀嚼功能。 根据《医疗器械分类目录》,分类编码为17-08-01,管理类别为Ⅲ类。 一、牙科种植体(……
对同一医疗设备进行多项环境试验时,是否有先后顺序之分?
2024-10-29
环境试验是很多医用电气设备注册检验时必须进行的项目,这是产品稳定性研究的一项内容。通过环境试验可以验证产品在各种环境条件下的适应能力,对于试验过程中暴露的产品缺陷和故障,采取适当的整改措施,以改进产品在其预期使用环境下的适应性。那么假如同一设备需要进行多项环境试验,是否有先后顺序之分呢? 根据GB/T 1……
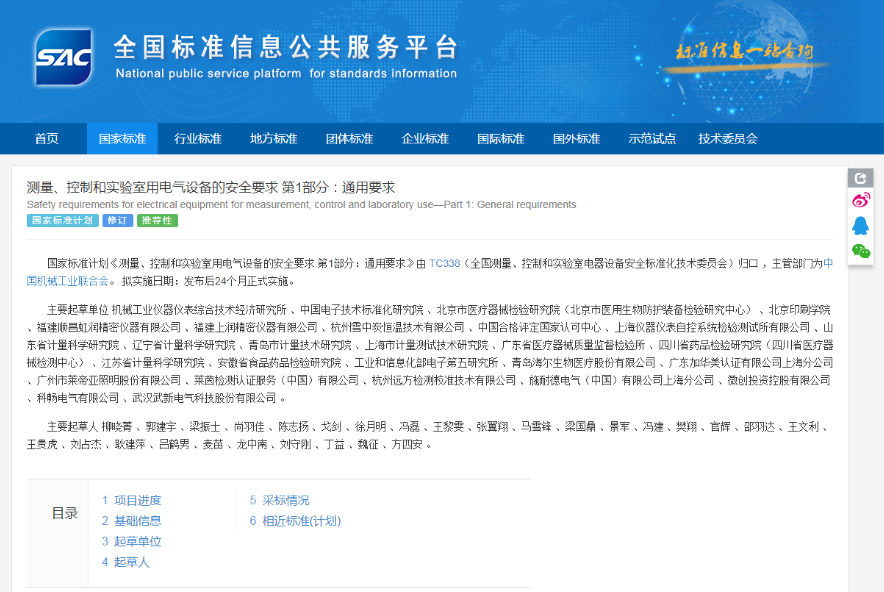
GB/T 42125.1—2024系列国家标准批准发布
2024-10-29
2024年10月26日,官网显示GB/T 42125.1—2024《测量、控制和实验室用电气设备的安全要求 第1部分:通用要求》系列国家标准批准发布,新版标准将于2026年11月1日起正式实施。 本次共涉及以下标准: ……
无源医疗器械“组合包类”产品注册问题答疑
2024-10-24
1、组合包类产品是否可以以主配、选配组件配合使用的方式进行注册? A: 共识:主选配形式可以接受,但主配件应体现申报的包类产品的主体功能性。企业在首次申请时应自行明确和产品主体功能相适应的主、选配组件;若发生注册变更,应不影响包类产品的主体功能。 涉及到G家有发布注册指导原则的包类,其主、选……
无源医疗器械常见注册问题答疑
2024-10-22
在第二类医疗器械技术审评和注册咨询中,我们发现部分企业对医疗器械注册法规和标准要求、申报资料准备、研究评价标准和方法仍缺乏认识和了解,现将技术审评发补中的常见问题以及日常咨询中的共性问题进行梳理,希望能让大家更直观、更详细地了解相关技术审评要求,不断提升我省医疗器械注册申报的质量和效率。 1、 一次性使用……
《富血小板血浆制备器注册审查指导原则》公开征求意见(附全文)
2024-10-22
刚刚,G家药品监督管理局医疗器械技术审评中心发布《富血小板血浆制备器注册审查指导原则(征求意见稿)》,内容如下: 富血小板血浆制备器注册审查指导原则(征求意见稿) 本指导原则旨在指导注册申请人进行富血小板血浆制备器注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的审评提供参考。 ……
有源医疗器械内置充电电池关于指示器的要求
2024-10-21
在有源医疗器械领域,内置充电电池的应用日益广泛,尤其是在便携式和移动式设备中,以确保设备的持续可用性和操作灵活性。GB 9706.1-2020作为医疗电气设备安全的基本标准,对内置充电电池的指示器要求进行了详细规定,旨在保障操作者的安全和设备的正确使用。本文将深入探讨该标准中条款15.4.4的含义,以及如何通过合规的设……