《膀胱超声扫描仪注册审查指导原则》正式发布(附全文)
2023-07-10
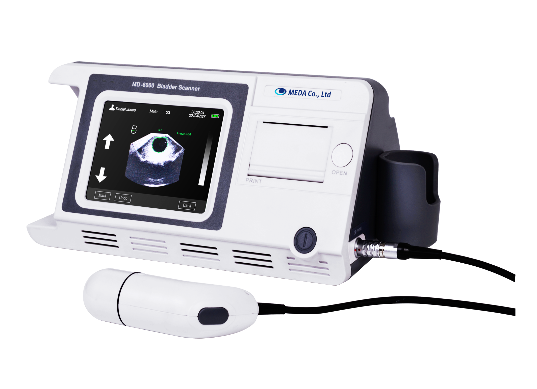
刚刚,GJ药监局器审中心发布《膀胱超声扫描仪注册审查指导原则》,内容如下: 膀胱超声扫描仪注册审查指导原则 本指导原则旨在指导注册申请人对膀胱超声扫描仪注册申报资料的准备及撰写,同时也为技术审评部门提供参考。 本指导原则是对膀胱超声扫描仪产品的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适……
《医用分子筛制氧机注册审查指导原则》正式发布(附全文)
2023-07-10
刚刚,GJ药监局器审中心发布《医用分子筛制氧机注册审查指导原则》,内容如下: 医用分子筛制氧机注册审查指导原则 本指导原则旨在指导注册申请人对医用分子筛制氧机产品注册申报资料的准备及撰写,同时也为技术审评部门提供参考。 本指导原则是对医用分子筛制氧机的一般要求,申请人应依据产品的具体特性确定其中内容是……
《肠道水疗机注册审查指导原则》正式发布(附全文)
2023-07-10
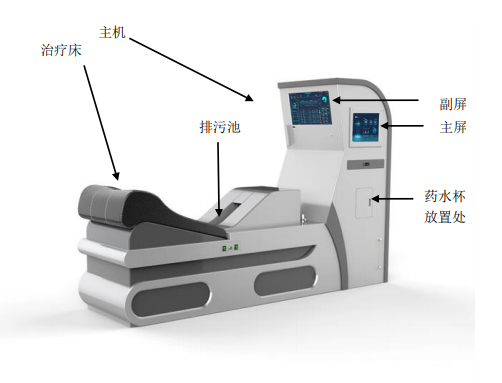
刚刚,GJ药监局器审中心发布《肠道水疗机注册审查指导原则》,内容如下: 肠道水疗机注册审查指导原则 本指导原则旨在指导注册申请人对肠道水疗机注册申报资料的准备及撰写,同时也为技术审评部门提供参考。 本指导原则是对肠道水疗机的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体……
电动轮椅安全风险突出!中消协发布养老辅助器具消费体验结果,与爸妈养老有关!
2023-07-10
近日,中国消费者协会发布了养老辅助器具消费体验项目报告。报告显示,目前市场上销售的一些养老辅助器具质量不佳、溢价高、功能鸡肋等问题亟待改善。 中消协这次组织开展的养老辅具消费体验项目,共选择了助行车、电动轮椅、爬楼机、移位机、移动马桶、翻身护理器、坐便助力器、马桶扶手、洗澡椅等9类产品,共计50款样品进行……
《医用呼吸道湿化器注册审查指导原则》正式发布(附原文)
2023-07-08
刚刚,GJ药监局器审中心发布《医用呼吸道湿化器注册审查指导原则》,内容如下: 医用呼吸道湿化器注册审查指导原则 本指导原则旨在指导注册申请人对医用呼吸道湿化器注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对医用呼吸道湿化器的一般要求,申请人应依据产品的具体特性确……
《血液融化设备注册审查指导原则》正式发布(附全文)
2023-07-08
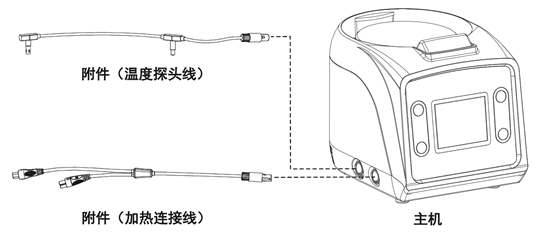
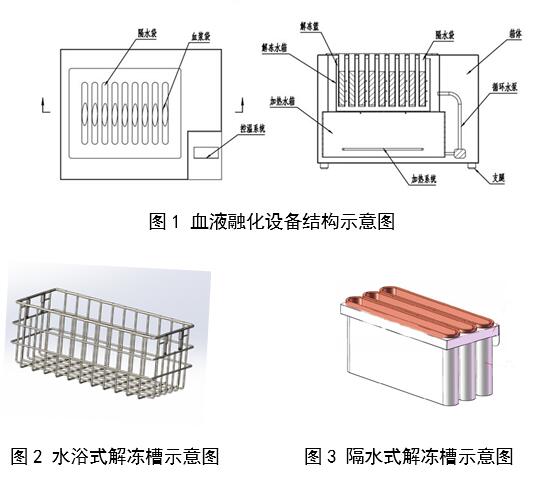
刚刚,GJ药监局器审中心发布《血液融化设备注册审查指导原则》,内容如下: 血液融化设备注册审查指导原则 本指导原则旨在指导注册申请人对血液融化设备注册申报资料的准备及撰写,同时也为技术审评部门提供……
血管介入器械润滑涂层风险评估及监管探索
2023-07-08
20世纪80年代中期以来,在介入心脏病学、介入神经放射学及介入血管外科领域,广泛应用聚合物(包括亲水性聚合物如聚乙烯吡咯烷酮、聚丙烯酸,以及疏水性聚合物如聚四氟乙烯等)作为血管内导管/导丝等器械的润滑涂层,增强了该类介入器械表面的润滑性及其在血管内的通过性,可降低血管壁损伤风险,并防止血管痉挛及血栓形成。润滑涂层的应用……
GB9706三版系列标准:基本性能
2023-07-06
GB 9706.1-2020,即对应IEC 60601-1第三版的标准,除了引入风险管理,另一个重大变化是对设备的要求从第二版标准基本安全变为基本安全和基本性能。 快二十年前,某次讨论一个问题:如某厂家超声诊断设备可以通过IEC 60601-1所有测试,并能满足标准中其他要求,但这个超声设备图像极其模糊。这样情况下,我们能不能给这台设备签发IEC 60601-1测试合格报告?当然这是为了讨论问题,假设的极端场景。当时的答案是可以的,其时IEC 60601-1为第二版,其要求只关注基本安全,对产品进行
GB9706三版系列标准:如何理解专用标准中的基本性能?
2023-07-06
如何理解专用标准中的基本性能? 专用标准作为针对某类产品的标准,在201.4章节关于基本性能识别,大致可以分为以下三种情形, 情形1),专标该章节未提及基本性能,如IEC 60601-2-22如下,201.4章节中未对基本性能作识别; IEC 60601-2-2……
GB9706三版系列标准:说说耐压测试的通过与否
2023-07-06
对电气安全来讲,耐压测试是个基本的测试。今天探讨下与耐压测试相关一小问题:在某次耐压测试中,如果在耐压测试仪设置在低漏电流限值比如10mA时,测试时设备会报警提示失败,但当我们把这个限值调高到一些,比如20mA,测试又是通过的。那么这次的测试究竟是通过还是未通过呢? 关于耐压测试,我们普遍的理解就是:耐压测试是评……
GB 9706.1-2020下锂电池的问题
2023-07-06
GB 9706.1-2020实施在即,大家越来越关注各类符合性的问题,这几天好几个小伙伴都问到了锂电池的相关问题,因为GB 9706.1-2007中只需要考虑电池的安全要求,并不直接的电池标准要求,但是GB 9706.1-2020中引入的相应的电池标准,而且通常来讲,锂电池都有UL2054,UL1642以及IEC 62133等报告,但是令大家困惑的是GB 9706.1中并没有列出这几个常用的标准或者说存在一些版本的偏差,那今天就来跟大家聊一聊这一个问题。 GB 9706.1-2020的15.4.3.