GB 9706.1-2020下的电源开关标识问题
2023-07-06
今天来聊聊GB 9706.1-2020下的电源开关标识问题。 谈GB 9706.1-2020之前先来看看GB 9706.1-2007中关于电源开关的问题, 之前有行业大佬分析过这个问题,总结出来主要的问题就是: 1、GB9706.1-2007对I O 的解析是否只能是总电源通断; 2、GB 9706.……
GB 9706.1-2020下的外壳防火材料要求
2023-07-06
GB 9706.1-2020的变化中有对于防火的要求显然也是一个比较重大的改变, 在11.3条款中给出了很多的ME设备防火外壳的结构要求, 除了底部开孔和侧面开孔的细致要求外, 对于防火外壳内的绝缘线、连接器、印制电路板和安装在元器件上的绝缘材料要求符合GB/T5169.16的相当于或者优于FV-2的可燃等级,除此之外,可转移ME设备的非金属材料也要相当于或者优于FV-2等级,固定ME设备或非移动ME设备应相当于或者优于FV-1的等级。 但是说起塑料外壳的防火等级,大家一定会马上想起UL94,毕竟U
浅谈GB 9706.1下的风险管理之风险分析
2023-07-04
标准的从业者就是个翻书挖宝的人,蹭个热度, 言归正传。接上篇,万事开头难,这次我们就来聊聊风险管理中的第一步--风险分析。 风险分析的前提是首先需要明确所做风险分析产品的1. 预期用途和可合理预见的误使用:需要注意的是此处的预期用途需要考虑预期使用者、预期使用环境、预期使用场景以及产品的工作原理。同时在考虑使用时……
浅谈GB 9706.1下的风险管理之一
2023-07-04
后台很多小伙伴要求讲一讲风险管理,因为GB 9706.1-2020的实施,很大的一个变化就是引入了风险管理的理念,之前有一遍写过关于GB 9706.1下的风险管理该如何来做,今天就回归到风险管理的源头开始讲起。 说起风险管理,那自然少不了YY/T 0316-2016(ISO 14971:2007)和YY/T 14……
医用电气设备防尘防水(IP)等级要求及标记
2023-07-04
什么是防尘防水(IP)等级? IP是IngressProtection的缩写,IP等级是针对电气设备外壳对异物侵入的防护等级,来源是国际电工委员会的标准IEC 60529 IP代码组成 IP代码通常由两位数字或字母组成 IP N1N2 N1:防止固体异物进入……
药物临床试验机构监督检查要点和判定原则征求意见
2023-07-04
近日,GJ药监局核查中心发布《药物临床试验机构监督检查要点和判定原则(征求意见稿)》,内容如下: 药物临床试验机构监督检查要点和判定原则(征求意见稿) 为加强药物临床试验机构(以下简称机构)监督管理,根据《药品管理法》《药品注册管理办法》《药物临床试验质量管理……
医疗器械无菌包装性能要求
2023-07-04
微生物屏障能力的无菌包装材料 应具有屏障微生物的能力,应具有提供、维护产品无菌的基本功能。 对于保障包装的完整性和产品的安全起到十分重要的作用。 对于无菌医疗器械来说,无菌性不能保障被认为是最严重的不合格事件。 评价微生物屏障特性的方法分两类: 1)……
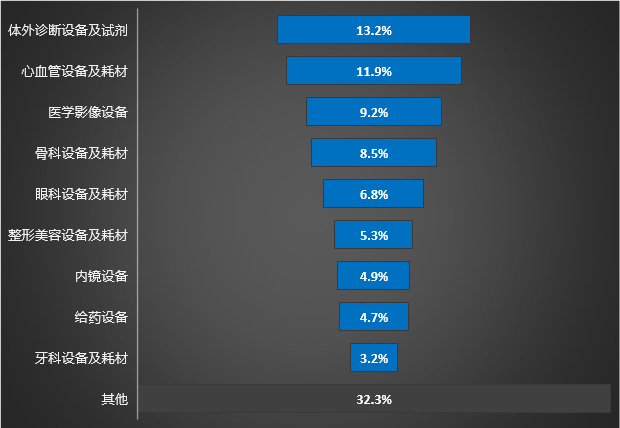
医疗器械皇冠上的明珠将依然欣欣向荣
2023-07-03
2022年,全球医疗器械市场已突破5000亿美元,2021-2025年复合增长率达5.4%,已匹配全球最具科技含量的半导体行业,预计2023年市场规模将超过8000亿美元。 与此同时,2022年中国医疗器械市场也已突破9000亿元(约1280亿美元),2021-2025年复合增长率达13.7%,接近全球增……
医疗器械设计开发控制中生物相容性要求
2023-07-03
了解生物相容性 确保医疗器械及其组件(材料)安全或生物相容性是所有设计开发控制程序的基本因素。生物相容性通常通过回答两个基本问题的试验来确定: 1.材料是否安全? 2.其是否具有预期功能所需的物理和机械性能? 生物材料通常是一个复杂的实体,材料毒性受物理和化学性……
CMDE 30个医疗器械审评共性问题(2023年1-6月)
2023-07-03
1、关于激光选区熔化金属粉末产品的生产工艺需考虑哪些方面 需明确金属粉末制备的生产加工工艺,明确关键工序、特殊过程及其控制点及相应参数信息。关于制粉母材需明确通用名称、化学名称、符合的标准及牌号、材料供应商、入厂检验标准等关键信息及质控要求;明确制粉主要生产工艺,如电极感应熔化气体雾化、等离子惰性气体雾化……
橡胶的阻燃技术、阻燃机理及阻燃剂介绍
2023-06-30
橡胶的阻燃技术 除少数合成橡胶外,大多数合成橡胶制品与天然橡胶一样,都是易燃或者可燃材料。目前主要采用添加阻燃剂或阻燃填充剂的方法及与阻燃材料共混改性来提高阻燃性。另外,聚合时在单体中引人阻燃基团也是阻燃技术中的有效方法,提高橡胶制品的交联密度对阻燃也有好的影响。橡胶的阻燃技术简单介绍如下: ……
盘点25家血透机企业及血透机气泡监测测试系统的介绍
2023-06-29
血液透析是指血液通过半透膜与透析液进行溶质交换的过程。血液透析装置一般包括透析器、透析液配比装置、血液和透析液监控装置。截至2023年5月10日,NMPA数据显示有25家企业共45款血液透析机注册证在有效期内。一、NMPA获批血透机列表 01、费森尤斯 费森尤斯成立于1912……