发布人:管理员 发布时间:2022-09-30
口腔保持器注册审查指导原则
本指导原则旨在指导注册申请人对口腔保持器注册申报资料的准备及撰写,同时也为技术审评部门审评提供参考。
本指导原则是对口腔保持器的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由并说明相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供申请人和审评人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围
本指导原则中保持器适用于巩固牙颌畸形矫治完成后的疗效。
根据《医疗器械分类目录》,保持器的管理类别为Ⅱ类,分类编码为17-07-07。
本指导原则适用于活动的定制式保持器,如哈利氏保持器(Hawley保持器)、压膜保持器。固定式保持器(如舌侧保持器)、非定制式保持器(如非定制式硅胶保持器)等不适用于本指导原则。
二、注册审查要点
(一)监管信息
1.申请表
1.1产品名称
产品名称应与产品特征一致,由一个核心词和一般不超过三个特征词组成。命名举例:保持器、正畸保持器、定制式保持器、可摘保持器。
1.2注册单元划分的原则和实例
保持器注册单元原则上以产品的技术原理、结构组成、性能指标和适用范围为划分依据。
例如:产品结构组成、性能指标不同,Hawley保持器与压膜保持器建议不作为同一注册单元申报。
膜片材质不同的压膜保持器建议不作为同一注册单元申报。
2.术语、缩写词列表(如适用)
3.产品列表
4.关联文件
5.申报前与监管机构的联系情况和沟通记录(如适用)
6.符合性声明
(二)综述资料
1.概述
1.1产品的通用名称及其确定依据
1.2产品的管理类别
1.3适用范围
1.4如适用,描述有关申报产品的背景信息概述或特别细节,如:申报产品的历史概述、历次提交的信息,与其他经批准上市产品的关系等。
2.产品描述
2.1器械及操作原理描述
2.1.1产品工作原理/作用机理
牙颌畸形矫治完成后,牙和颌骨有退回到初始位置的趋势;矫治后牙齿周围的骨骼及邻接组织需要一定时间完成改建(正畸治疗后6~12个月牙周组织完成重建,而弹性纤维的改建需要1年左右[1])、建立的平衡、更改口腔不良习惯;而生长发育、第三恒磨牙萌出等因素也会影响治疗效果。因此需要采取一定的措施,在此期间将牙齿维持在理想的美观及功能位置,防止牙齿移动。该措施即保持 (retention)。保持是矫治过程不可或缺的一个重要阶段和组成部分[2]。
采用机械保持装置(保持器 retainer),可将牙齿或颌骨稳定于矫治后的特定位置,保持临床治疗效果,防止复发(relapse)[3]。
2.1.2产品的结构和组成
适用于本指导原则的保持器主要分为Hawley保持器和压膜保持器,形式如图1:
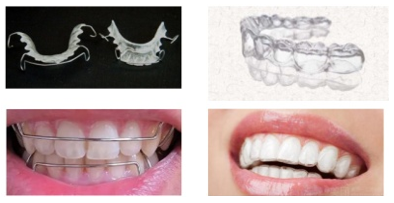
图1 保持器形式(左为Hawley保持器 ,右为压膜保持器)
Hawley保持器通常由正畸丝、正畸基托聚合物等制成。
压膜保持器通常由医用级聚氯乙烯、聚对苯二甲酸乙二醇酯(PET)、聚对苯二甲酸乙二醇酯-1,4-环己烷二甲醇酯(PETG)或聚氨酯等材料,经热压、打磨、抛光而成。
2.2型号规格
2.3包装说明
2.4研发历程
2.5与同类和/或前代产品的参考和比较
3.适用范围和禁忌证
3.1适用范围:用于巩固牙颌畸形矫治完成后的疗效。
3.2预期使用环境:产品首次使用时在有资质的医疗机构由专业牙医为患者装戴,调试好后可由患者日常自行装戴,并根据医嘱定期复诊。
3.3适用人群:本产品目标人群为需要巩固正畸矫治完成后疗效的患者。
3.4禁忌证:
3.4.1患有全身系统性疾病并经过口腔专科医生和全科医生综合评估不适合佩戴保持器的情况;
3.4.2对保持器材料过敏者。
4.申报产品上市历史(如适用)
(三)非临床资料
1.产品风险管理资料
应参照YY/T 0316《医疗器械风险管理对医疗器械的应用》对保持器进行风险分析,对产品生命周期全过程实施风险管理。以下依据YY/T 0316附录E列举了保持器的主要危害举例(见表1)。
表1 保持器的主要危害举例
|
危害的分类 |
危害的形成因素 |
可能的后果 |
|
|
生物学危害 |
生物不相容性 |
用于生产加工保持器的材料,不具有良好的生物相容性。 推荐的消毒方法导致材料发生变化不具有良好的生物相容性。 |
产生毒性、刺激等反应,如牙龈刺激、红肿等。 |
|
材料过敏 |
使用前未了解患者过敏史,未在说明书中警示;或材料的金属有害元素超标。 |
引起患者过敏 |
|
|
再感染和/或交叉感染 |
使用前未有效清洁、消毒;设计单上标记与模型不一一对应,标识不清。 |
引起患者局部、交叉感染。 |
|
|
机械 危害 |
产品表面不光滑 |
产品粗糙部分磨损、划伤牙龈、口腔粘膜及或软组织等。 |
对患者牙龈、口腔黏膜及软组织造成意外伤害。 |
|
不适当的材料或加工过程中工艺参数的控制失效,如力学性能无法满足要求 |
未选择正确的原材料或生产过程控制失效。 |
保持器断裂,可能导致患者误吞、刺破患者口腔内软组织,对患者造成伤害。
|
|
|
操作 危害 |
不适当的操作说明 |
(1)患者未按说明书推荐的方法清洗,导致保持器发生腐蚀变形。 (2)患者未按时复诊,未及时调整保持器导致正畸后保持效果无法达到预期。 (3)患者保持器佩戴后感觉不适或松动,未及时就医调整,自己手动修正。 (4)患者未遵医嘱及说明书要求保持良好的口腔卫生习惯。 |
(1)无法保证使用的有效性或无法正常使用。 (2)保持器断裂,可能导致患者误吞、刺破患者口腔内软组织,对患者造成伤害。 (3)引发龋坏、牙周疾病等口腔问题。 |
|
环境 危害 |
储存偏离预定的环境条件 |
储运条件(如温度、湿度、酸碱度)不符合要求。 |
产品变色、锈蚀。 |
|
意外的机械破坏 |
储运、使用过程中发生意外的机械性破坏。 |
产品使用性能无法得到保证或者无法保证正常使用。 |
|
企业还应根据自身产品特点确定其他危害,可通过产品设计控制、产品原材料选择、产品技术性能指标的制定、正确的标签标识、生产和检验控制、产品说明书等多项措施以降低风险至可接受水平。
2.医疗器械安全和性能基本原则清单
3.产品技术要求及检验报告
3.1申报产品适用标准情况
3.2产品技术要求
产品技术要求的制定应符合《医疗器械产品技术要求编写指导原则》的法规要求。申请人应依据产品的技术特征和临床使用情况来确定产品安全有效、质量可控的技术要求和检验方法。本指导原则给出保持器需要考虑的产品基本技术性能指标,申请人根据自身产品的技术特点和用途制定相应的性能指标,且性能指标不得低于强制性[敏感词]标准、行业标准。
3.2.1Hawley保持器产品性能指标至少应包括以下几点:
3.2.1.1设计:应按医疗机构提供的工作模型及设计文件制造。
3.2.1.2原材料:保持器的制作,应使用具有医疗器械注册证书或备案凭证的原材料,如使用未经注册的原材料,应列出适用的性能指标,如正畸基托聚合物应按YY/T 0270.2《牙科学 基托聚合物 第2部分:正畸基托聚合物》列出适用的性能指标。
3.2.1.3外观:保持器暴露于口腔的金属部分应高度抛光,其表面粗糙度应达到Ra≤0.025μm。固位体、基托、卡环、连接体的表面应光滑、有光泽、无裂纹、无孔隙。
3.2.1.4组织面:保持器的组织面不得存在残余石膏。
3.2.1.5色稳定性:基托树脂部分应颜色均匀,具有良好的色稳定性。
3.2.1.6密合度:保持器应与工作模型贴合牢固,不易松脱。
3.2.1.7正畸丝应一体成型,不应有明显的弯制痕迹。
3.2.1.8保持器的树脂基托部分最薄处应不小于0.6mm。
3.2.2压膜保持器产品性能指标至少应包括以下几点:
3.2.2.1设计:应按医疗机构提供的工作模型及设计文件制造。
3.2.2.2原材料:应为具有医疗器械注册证的牙胶片/牙科膜片制成,如使用未经注册的原材料,应列出适用的性能指标。
3.2.2.3产品基本要求:
外观:产品内、外表面和边缘应光滑,不得具有外来杂质、污点、裂纹/缝、鼓泡、锋棱、毛刺、孔隙、划痕等缺陷。
颜色:保持器应无色透明。如有个性化需求,需符合企业的宣称。
覆盖: 压膜保持器应覆盖全部牙列,如果有第三磨牙,应覆盖该牙近中部分。
尺寸准确性:保持器与工作模型的平均尺寸偏差应≤0.5 mm。
3.2.2.4物理性能:
密度:不大于2.6g/cm3。
厚度:产品的厚度应在宣称的范围内(明确最小值)。
吸水值:保持器单位体积质量的增加(吸水量)不应超过32µg/mm³。
拉伸性能:保持器的拉伸弹性模量应介于500MPa~2400MPa范围内。
耐磨耗性能:产品按附录的方法一试验,质量损失应小于0.25g/1000r。
耐撕裂性能: 直角撕裂强度应大于100kN/m。
溶解值:保持器单位体积质量的损失(水溶解性)不应超过1.6µg/mm³。
密合度:保持器应与工作模型贴合牢固,在模型上不应有翘起、摆动、旋转、下沉等不稳定现象。
热稳定性:产品按附录的方法二试验,质量变化不超过1%。
色稳定性(如适用):保持器应颜色均匀,具有良好的色稳定性。
3.2.2.5化学性能:
酸碱度:检验液和空白液pH值之差应不超过1.5。
重金属总含量:检验液中重金属总含量应不超过1μg/ml。
还原物质(易氧化物):检验液和空白液消耗高锰酸钾溶液[ c (KMnO4)=0.002mol/L]的体积之差应不超过2.0ml。
蒸发残渣:蒸发残渣的总量应不超过2mg。
上述性能指标若在牙胶片/牙科膜片阶段已经检测,申请人如能证明生产加工工序对该类指标无影响,可免于在成品阶段重复检测。
3.3检验报告
3.3.1检验报告可以是申请人按照《医疗器械注册自检管理规定》出具的自检报告,也可以是委托有资质的医疗器械检验机构出具的检验报告。
3.3.2同一注册单元内所检验的产品应当能够代表本注册单元内其他产品的安全性和有效性。
4.研究资料
根据所申报的产品,提供相应的研究资料。
4.1化学和物理性能研究
原材料已取得医疗器械注册证或备案凭证,申请人需提供原材料供应商信息及验收标准。
原材料由申请人自行研发生产的,需明确各种原料的化学名称、CAS号、金属牌号、化学结构式/分子式、分子量(如适用)、来源和纯度(如适用)、使用量或组成比例、作用、符合的标准、申请人的验收标准及相关的支持性资料,建议以列表的形式提供,并说明原材料的选择依据及来源。
申报资料中应包括产品性能研究资料以及产品技术要求的研究和编制说明,包括所有指标的确定依据,所采用的标准或方法、采用的原因及理论基础。
Hawley保持器的力学性能与弯制钢丝及医生安装调试相关,可不单独进行研究。
压膜保持器的力学研究对维持矫治效果和舒适度等方面有着重要影响,[敏感词]给出一些常见的力学研究项目和研究方法供参考。
研究项目:材料的短期力学表现,如弹性模量、屈服强度、极限强度、残余应力、蠕变极限等参数;材料的长期力学表现,主要是应力松弛性能及对不同环境侵蚀的抵抗性能。
研究方法:对材料力学性能的研究通常是用专用仪器进行拉伸试验及松弛试验,对保持器力学表现的研究主要是通过理论应力分析法及实验应力分析法。理论应力分析法通常使用的是有限元法模拟,实验应力分析法可以是电测法或模拟试验法。
4.2生物学特性研究
保持器接触口腔黏膜表面和牙齿硬组织外表面,属于表面接触的器械,根据YY/T 0268《牙科学口腔医疗器械生物学评价第1单元:评价与试验》,接触时间结合产品具体的使用方法确定,应考虑累计使用时间,生物相容性评价应遵循GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》和YY/T 0268《牙科学口腔医疗器械生物学评价第1单元:评价与试验》相关要求。
对于使用已取得医疗器械注册证原材料制作的Hawley保持器可豁免生物学试验,并将注册证作为生物相容性评价研究资料的一部分。
对于使用已取得医疗器械注册证原材料制作的压膜保持器,豁免生物学试验的理由中应提供产品经生产加工后对原材料生物相容性安全无影响的研究资料。
若不能说明豁免生物学试验的理由或使用未取得医疗器械注册证的原材料,应考虑潜在的累计作用,可根据YY/T 0268《牙科学口腔医疗器械生物学评价第1单元:评价与试验项目选择》和GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》,按接触的总时间评价成品,生物学试验项目建议至少考虑:细胞毒性、迟发型超敏反应、刺激或皮内反应、亚慢性全身毒性、遗传毒性。
4.3清洁、消毒、灭菌研究
保持器通常由使用者清洁、消毒(如适用):应当明确推荐的清洗和消毒工艺(如适用)、工艺的确定依据以及验证的相关研究资料。若保持器经消毒后可能产生残留物质,应当对消毒后的产品进行残留毒性的研究,明确残留物信息及采取的处理方法,并提供相关研究资料。
4.4证明产品安全性、有效性的其他研究资料。
5.非临床文献
6.稳定性研究
6.1应明确保持器产品的安装有效期,即在患者口腔内取模至安装的最长期限。还应明确产品的质保期。
6.2运输稳定性:应明确产品的内包装形式并确保包装在宣称的运输储存条件下,在产品有效期内能够对产品起到防护作用并保持产品清洁。产品包装验证可参考GB/T 19633.1、YY/T 0681.15等标准进行,提交产品的包装验证报告。包装材料的选择应考虑以下因素:包装材料的物理化学性能;是否会引入重金属、微生物等外来物质;包装材料与成型和密封过程的适应性;包装材料与产品的适应性;包装材料与标签系统的适应性;包装材料与贮存运输过程的适合性;包装有效期。包装验证的资料内容应与包装说明中给出的信息相符。
(四)临床评价资料
申请人应按照《医疗器械临床评价技术指导原则》选择临床评价路径,提交临床评价资料。
1.通过同品种医疗器械临床数据进行分析、评价
按照《医疗器械临床评价等同性论证技术指导原则》,产品性能需与同品种器械进行对比,如压膜保持器的拉伸性能、耐撕裂性能等相关力学性能指标,申请人可通过实测获得对比数据,亦或通过原材料检验报告获得实测数据。值得注意的是,申报产品和对比产品的试验条件需一致。
对于部分性能指标,[敏感词]/行业标准和ISO标准已制定了接受限值,按照标准中的方法和参数进行测试,结果符合标准接受限值要求,一般不再要求与同品种器械进行测试对比。例如:YY/T 0270.2《牙科学 基托聚合物 第2部分:正畸基托聚合物》、YY/T 0114《医用输液、输血、注射器具用聚乙烯专用料》(如适用)等相关标准中有明确接受阈值的性能要求可不进行对比,申报产品检验报告中的实测值符合相关标准要求即可,如吸水值、溶解值、酸碱度、重金属总含量、还原物质、蒸发残渣。
所选择的同品种产品与申报产品在部分项目上虽有差异,但综合评价两者应基本等同。对比项目中同品种信息无法获取的,如生产工艺、原材料牌号等,也可不填写直接作为差异项,提供相匹配的安全有效性证据。
2.通过临床试验数据进行分析、评价
已有临床文献资料、临床数据不足以确认保持器安全、有效的,应开展临床试验。在中国境内开展行临床试验的,需符合《医疗器械临床试验质量管理规范》的相应要求;在境外开展临床试验的,需符合《接受医疗器械境外临床试验数据技术指导原则》的相应要求。
(五)产品说明书和标签样稿
产品说明书和标签要求的编写应符合《医疗器械说明书和标签管理规定》和相关标准的要求,同时还应注意以下几点(不限于此):
1.原材料相关信息。
2.建议每天佩戴时间。
3.产品使用说明、禁忌证及其他应该说明的问题等。
4.注意事项应明确以下内容:
4.1需要在具有专业资质的医师指导下进行首次佩戴。
4.2保持器戴用前应经过清洁消毒并根据产品的材料特性明确推荐的清洁消毒方法。
4.3对治疗依从性要求的提示性语言。
4.4进食、刷牙的要求。
4.5过敏反应的处理方法。
4.6在贮存、运输过程中的要求。
5.禁忌证至少应有以下内容:
5.1患有全身系统性疾病并经过口腔专科医生和全科医生综合评估不适合佩戴保持器的情况;
5.2对保持器材料过敏者。
(六)质量管理体系文件
1.综述
2.生产制造信息
3.质量管理体系程序
4.管理职责程序
5.资源管理程序
6.产品实现程序
7.质量管理体系的测量、分析和改进程序
8.其他质量体系程序信息
9.质量管理体系核查文件
三、参考文献
[1] 赵志河. 人民卫生出版社《口腔正畸学》:第7版[M].北京:人民卫生出版社,2020.
[2] Lee W. Graber. 口腔正畸学-现代原理与技术:第6版[M].王林,译.江苏: 江苏科学技术出版社,2018.
[3]YY/T 0270.2,牙科学 基托聚合物 第2部分:正畸基托聚合物[S].
[4]YY/T 0316,医疗器械风险管理对医疗器械的应用[S].
[5] YY/T 0466.1医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求[S].
附录
口腔保持器性能指标的相关试验方法
方法一:耐磨耗性能—滚动磨损试验方法
1.样品准备:取不少于三个试样,直径为100mm,厚度0.5~10mm。
2.样品处理:用中性挥发溶剂或中性洗涤液清洗试样表面。
3.试验步骤:使用滚动磨耗试验仪(GB/T 5478),采用H18磨轮,在载荷4.9N,转速为60r/min的条件下进行测试。
4.结果记录:记录达到规定转数(1000r)时试样的质量损失平均值,[敏感词]至0.01g。
方法二:热稳定性试验方法
1.仪器要求:使用符合精度要求的热重分析仪(或相似仪器)。
2.样品处理:用切片机或刀片切取10~100mg样品,样品的尺寸应与所用坩埚匹配。
3.试验步骤:启动仪器,设定恒温温度为材料的热成型温度,加热时间为5分钟,快速升温至设定的温度,采用等温模式获得质量单阶损失的TG曲线,如图1所示。
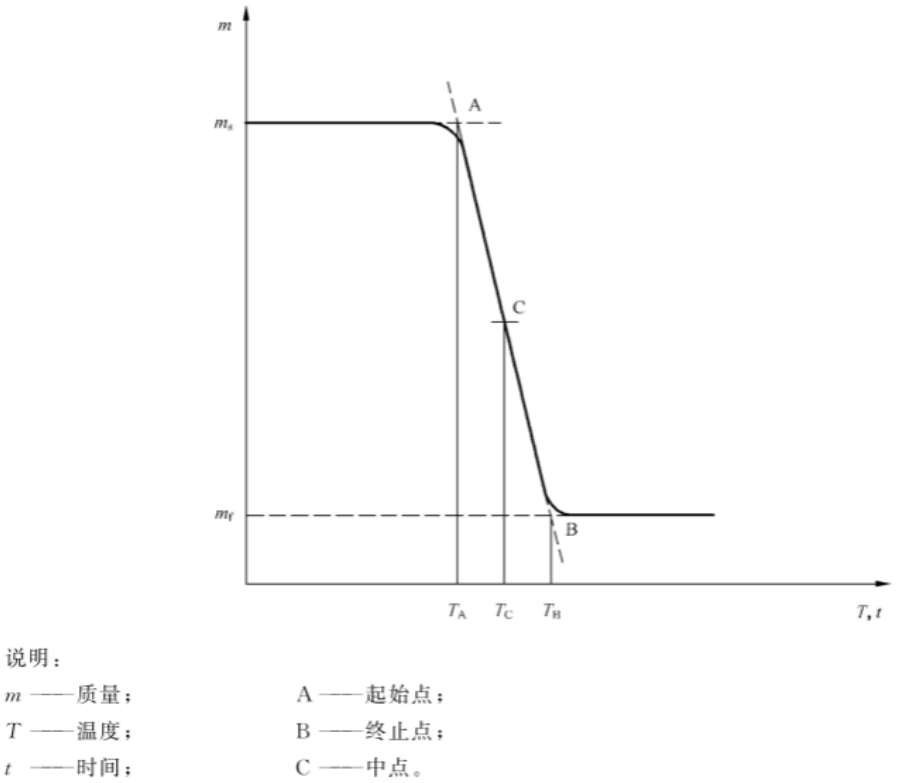
图1 质量单阶损失的TG曲线示例
从TG曲线确定A、B和C点,其中:
A起始点:起始质量的延长线与TG曲线上梯度变化[敏感词]点处切线的交点;
B终止点:终止质量的延长线与TG曲线上梯度变化[敏感词]点处切线的交点;
C中点:TG曲线与两基线等距离的交点。
确定起始点质量ms和终止点质量mf。
4.结果记录:按照如下公式计算样品的质量变化,测试两个试样,取平均值。
质量变化(%)=|ms-mf|/ms×100%