发布人:管理员 发布时间:2022-10-09
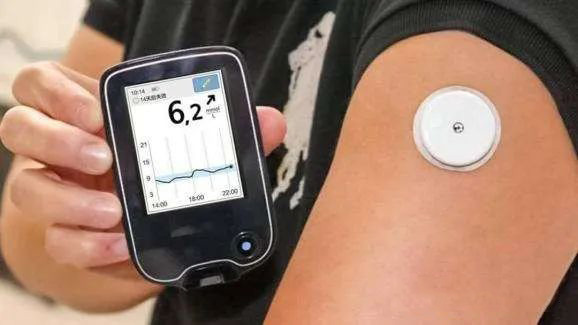
持续葡萄糖监测系统注册审查指导原则2022年修订版(征求意见稿)
本指导原则是对持续葡萄糖监测系统(Continuous Glucose Monitoring System,CGMS)的一般要求,申请人应依据产品的具体特性确定其中的内容是否适用。若不适用,需具体阐述其理由及相应的科学依据,并依据具体的产品特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,相关内容也将适时进行调整。
一、适用范围
本指导原则适用于微创式CGMS,附加血糖/血酮/其他检测模块的产品还应满足血糖仪等其他检测模块注册审查指导原则的相关内容。
连接智能移动终端、胰岛素自动给药装置、手动控制的治疗仪器的集成式持续葡萄糖监测系统(Integratedglucose monitoring system, iCGMS),应考虑增加连接对象注册审查指导原则的相关内容。
本指导原则不包括无创式及植入式CGMS。
注:产品分类参见附件1。
二、注册审查要点
(一)监管信息
产品名称
产品命名需符合《医疗器械通用名称命名规则》的要求。可采用持续葡萄糖监测系统进行命名。实时、回顾式、微创、无创等字样无需写入产品名称。
2.分类编码
依据《医疗器械分类目录》,申报产品分类编码为07-04-03。按第三类医疗器械管理。
3.产品注册单元
CGMS包括一次性使用葡萄糖传感器、发射器、附件等,应当作为一个注册单元进行注册。
以传感器为系统的核心部件作为产品注册单元的划分依据。如传感器材料不同应划分为不同注册单元。
传感器反应原理或作用机理不同时,应划分为不同注册单元。
回顾式与实时式CGMS,应划分为不同的注册单元。实时式CGMS包含回顾式持续葡萄糖监测模式的系统可以作为同一注册单元。
系统的性能指标有较大差异的,应划分为不同的注册单元。
如传感器设计不同,佩戴天数差异较大的,原则上应划分为不同的注册单元;传感器设计完全相同,通过软件设置实现不同佩戴天数的,可划分为同一注册单元。
专业医护人员与患者使用的应用程序,核心算法相同,显示界面,统计数据呈现方式不同可划分为同一注册单元。专业医护人员覆盖患者版,可以同一单元。否则建议划分不同单元。
具有血糖修正算法的应用程序,输入校准数据并传输至CGMS的应用程序,应与CGMS作为同一单元注册。
用于CGMS二次显示实时患者数据的移动应用程序,与CGMS应划分为不同注册单元。
数据传输头(蓝牙适配器)不单独注册,与CGMS作为一个注册单元进行注册。
(二)综述资料
1.产品描述
1.1工作原理
描述产品工作原理,包括系统工作原理(数据传输方式)以及其核心部分传感器的工作原理。提供框图及化学生物反应方程式详细说明。
如CGMS应用电化学反应原理,通过固定在传感器上的生物酶,如葡萄糖氧化酶,经植入到皮下组织中,测量组织液中的葡萄糖浓度。葡萄糖氧化酶测量的电信号,通过CGMS的发射器或接收器,以及算法处理,将电信号转化为葡萄糖浓度,显示到显示器或者软件里,形成葡萄糖监测图谱。
框图举例如下:

在监测图谱的基础上,可以分析患者每天的[敏感词]葡萄糖值、[敏感词]葡萄糖值及葡萄糖值波动的规律。实时显示葡萄糖数值时,还可以对患者提供高低葡萄糖报警,及葡萄糖趋势变化方向和速率等信息。
1.2结构组成
提供完成最终预期用途的整体系统的完整描述。包括各部件之间相互连接的图形化描述。
描述各部件间连接、组合、使用操作流程。描述传感器所[敏感词]的解剖部位。
描述CGMS所提供信息,例如:血糖值的报告频率、趋势信息、提示信息、评估报告。
描述系统内部每个功能组件。提供每个功能组件(含附件)的实物图、拆解图、结构图、三视图以及便于理解的必要注释。
-传感器描述传感电极、基座、胶布等结构。
-附件(如有)可能包括传感器辅助[敏感词]装置、充电器、传感器电极检测器、胶带等。发射器可能与传感器集成于一体;接收器可能与显示器、胰岛素泵集成于一体,也可能是移动设备(如手机)。移动设备通常不是产品的组成部分。
-软件包括记录采集传输数据的软件,用于转换电流信号为血糖信号的软件等。
1.3器械组件和附件的设计说明
对于其核心部分的传感器:
1.3.1采用电化学原理的传感器重点描述基体电极、葡萄糖限制膜层、助粘剂层(如有)、保护层(如有)、葡萄糖氧化酶层(或葡萄糖脱氢酶)等化学堆层的制造流程(如酶固化和涂膜处理工艺),明确各膜层溶液成分、规格、配比及制造商,并标注制造过程中使用的助剂,如化学交联剂戊二醛、起始剂等。
提供化学堆层示意图,图上标明各堆层成分。
提供传感器电极剖面放大图,描述基体电极结构(如,工作电极、参比电极、对电极)、各电极材料(铂、碳、Ag/ AgCl)、工艺流程(如丝网印刷工艺)等。
采用光学原理的传感器,结合图示详细描述荧光标记方法、葡聚糖和葡萄糖结合蛋白、光纤传感器的制造流程,明确各成分、规格、含量、制造商信息。
血糖检测模块描述光源器件、分光组件、光电转化处理电路、微控制单元、无线通信模块。
1.3.2如产品中含有生物安全风险类成分,应重点描述。如在制造过程中所使用的生物源成分(如酶),人类血液制剂(如人血清白蛋白)及动物源组织(如牛血清白蛋白)等的来源、制造商、监管类型(生物制品、药品)并提供与监管类型相适应的证书、明确符合的质量标准。
1.3.3反应原理及获取信号的方式等的描述。
参考附件1详细描述采用的传感技术,氧化反应的公式和电流值的算法等。
除描述主反应产生电流的化学方程式,同时需列明其他可能存在的副化学反应,并分析各副化学反应对产品电流信号和葡萄糖浓度对应关系的影响。
光学原理的传感器应明确发射光强度、生物传感器与葡萄糖反应产生荧光信号的原理等。
1.4器械组件和附件的功能
描述器械组件功能,包括信号采集、存储、传输、转换、显示、配套软件功能及运行平台,如:一次性使用葡萄糖传感器是一次性使用组件,其核心作用是将组织液中的葡萄糖信号检测出来,并转化为电流信号。电流信号的强弱与葡萄糖浓度成正比。
如,发射器为葡萄糖传感器供电,将传感器检测出来的电信号采集后转换为数字信号并经过过滤减少噪声和贮存,并通过有线和/或无线的方式发送至接收器。包括无线模块、校准算法、传感器电极完整性诊断等部分。
接收器通常带有信号处理软件组件,通过特殊的运算法则将收集到的电信号转化为葡萄糖数值,并以图表或图谱的形式显示给患者或专业医护人员。对于有些产品,信号接收和处理可能集成在发射器或移动设备所含应用软件上。
电子显示部分,描述产品提供数据方式(回顾式/实时式),得出数据的原理。
应当说明软件组成、运行环境及功能。
1.5通信路径功能组件的描述
通信路径功能组件的描述应包括功能组件之间的信息传递,包括允许进行信息传递的硬件和软件的描述。描述内容应包括:
1.5.1通信路径。申请人应描述各功能组件与系统内部其他功能组件进行通信的各种方式。申请人应确定功能组件之间的通信流(即单向或双向)并确定所传递的信息。
1.5.2通信硬件。申请人应描述各功能组件之间的信息传递方式并描述传递此信息所需使用的硬件。
1.5.3如果系统包括或预期包括射频无线技术(例如:IEEE 802.11、蓝牙、Zigbee),则描述应包括特定射频无线技术和特性、用途和功能(例如:远程监测或控制、软件更新)、待传输数据(包括以无线方式传输的任何报警)、所需的服务品质(QoS)、无线安全协议及与其他射频无线技术或电磁干扰(EMI)共存的相关限制或约束。
1.5.4描述远程监测功能的安全保证措施。
1.6与人体接触材料
描述与人体接触的部件名称、材料的化学名称、规格、组织接触类型及接触时间、材料来源(如葡萄糖氧化酶来源于黑曲霉)、高分子材料注明CAS号、金属材料注明牌号、材料符合的标准。结合图示进行材料说明,图中标识出与人体接触部件及材料。
1.7详细描述产品采用的核心技术。
2.型号规格
对于存在多种型号规格的产品,应当明确各型号规格的区别。应当采用对比表或带有说明性文字的图片、图表,描述各种型号规格的结构组成(或配置)、功能、产品特征和运行模式、技术参数等内容。
套件中独立包装的替换件型号可单独提供型号列表。
3.包装说明
应当说明有关产品包装的信息(如托盘、护盖材料、型号、关键指标(材料密度、抗拉强度、厚度))以及与该产品一起销售的配件包装情况。结合带有文字说明的图示明确包装内容物。
对于CGMS的传感器部分,应当说明与灭菌方法相适应的最初包装的信息,并提供产品包装的正反外观图示。
4.适用范围和禁忌证
4.1适用范围
明确说明产品的预期用途,应包含以下内容:
4.1.1应当明确检测的样本类型和临床意义。
如:用于检测组织间液中葡萄糖浓度,监测连续变化趋势并跟踪其持续波动趋势,辅助监测高血糖和低血糖的发生,不能作为治疗药物调整的依据。
4.1.2应当明确目标用户及其操作该产品应当具备的技能、知识、培训。
4.1.3应当明确适用目标人群,如成人、儿童、青少年、孕妇,患者选择标准的信息,并在临床评价资料中提供依据。
4.1.4明确预期的使用环境(医疗机构、家用环境)。如用于家用环境需提供可用于家用环境的临床证明。
4.1.5应当明确说明产品提供数据方式(回顾式/实时提供数据)、适用人群、高低血糖提醒功能等。
4.1.6应当明确说明该器械单独用于管理糖尿病,还是可与数字连接器械结合使用管理糖尿病。
适用范围示例:
该产品可用于糖尿病成年患者(≥18岁)的组织间液葡萄糖水平的连续或定期监测。产品可提供并存储实时葡萄糖值,供用户跟踪葡萄糖浓度变化的趋势,如葡萄糖水平低于或高于预设值,产品可发出提醒。葡萄糖传感器仅供单个用户使用,不需要用户进行校准,使用时间最长14天。产品测量结果不作为决定和调整糖尿病患者治疗方案的依据。
该系统预期在医疗机构使用/家庭环境使用。可单独或/和与经临床验证的血糖仪、蓝牙适配器结合使用。
该产品适用于实时连续监测18周岁及以上糖尿病患者组织间液葡萄糖水平,可替代指尖采血血糖检测,用于糖尿病患者的糖尿病治疗决策。
4.1.6其他注意事项:
如果工厂校准的CGMS同时也接受手动校准,需提供最小校准频率下的系统准确性和警示性能数据,并比较工厂校准及接受手动校准不同工作模式下的相关性能。
临床方案中的校准要求应与产品标签中的声称一致。校准频率应不超过产品标签中规定的频率。
临床证据应覆盖声称的所有适用人群(如儿童,青少年,18岁及以上I型糖尿病患者)、不同植入位置(如上臂、腹部、臀部等)、 并应区分不同葡萄糖浓度范围(如3.9mmol/L以下,3.9-10.0mmol/L,10.0mmol/L以上)进行数据分析。儿童与青少年人群应避免采血次数过多,应注意最小抽血量。样本量应足以分别显示每个部位、不同患者人群、不同葡萄糖浓度范围的数据有效性。临床主要评价指标20/20%一致率要求>80%; MARD%值要求<15%。报警成功率,定义为测量值低于报警阈值时的前后15分钟内。低浓度血糖3.9 mmol/L以下测量点数量占临床试验总测量点数比例不低于10%。
应由预期用户(如,医护人员、患者)植入传感器。
应提供传感器启动时间(指传感器从被植入开始,直至可传出有效血糖数据的时间)的研究资料。提供临床第1天前几小时的准确度数据。
如果声称可替代指尖采血血糖检测,用于糖尿病患者的糖尿病治疗决策,应提供额外的临床证据,准确性满足附件1的要求。
4.2禁忌证
根据产品特性,说明产品不适用的情况,如由于产品的传感器需要用胶布固定在皮肤上,所以过敏性皮肤患者或易患皮肤溃疡的人慎用等,在进行核磁共振成像之前,必须移除该产品。
5.参考的同类产品或前代产品的情况
应当阐述参考的同类产品或前代产品的情况,应当阐述申请注册产品的研发背景和目的。对于同类产品,应当说明选择其作为研发参考的原因。
同时列表比较说明产品与参考产品在工作原理(如有创、化学反应)、结构组成、制造材料(包括动物源性材料、药物成分、生物活性物质、符合的标准等信息)、性能指标、作用方式(如植入、介入)、适用范围、传感器存储条件(温度、湿度)、运行温度和灭菌有效期等方面的异同。
传感器性能指标比对资料应至少包括葡萄糖监测范围、线性、响应时间、重复性、稳定性、药物干扰、温度响应、氧化反应、防水性能、传感器佩戴时间(小时)、校正次数、报警功能、检测频率(分钟)、数据传输方式(蓝牙/近距离无线通信)等。
在对比材料中应注意突出注册产品与对比产品的不同,及不同点的原理基础和性能等,在前面资料应有相应描述。
6.其他需说明的内容
对于已获得批准的部件或配合使用的附件(如传感器、电子部分或助针器),应当提供注册证号和注册证信息。预期与其他医疗器械或通用产品组合使用的,应当提供说明。应当说明系统各组合医疗器械间存在的物理、电气等连接方式(如与胰岛素泵组合使用,说明其使用方式及数据传输运用的安全性)。除了持续葡萄糖监测功能外,如还有其他血糖或血酮检测功能,需要说明其特征、结构和原理。
(三)非临床资料
1.产品技术要求
依据《医疗器械产品技术要求编写指导原则》的规定编制产品技术要求。
符合的标准清单见附件2,产品技术要求示例见附件3。
2.检测报告
同一注册单元内所检验的产品应当能够代表本注册单元内其他产品的安全性和有效性。对同一注册单元内代表产品的选取应考虑产品预期用途、性能指标、安全指标、结构组成等,具体原则如下:
(1)性能指标、安全指标和结构组成一致,预期用途不同的产品,应选取预期用途最多的型号规格作为代表产品。
(2)同一注册单元产品如包含多个产品配置,一个检测单元应仅包含一个产品配置。
(3)同一注册单元产品如包含多个软件组件或多个版本的软件组件,则每个软件组件或每个版本软件组件构成的产品均应作为一个检测单元,除非检测系统具有典型性。检测报告应包含软件发布版本及软件完整版本的照片或信息。
(4)对于不同型号规格产品之间电磁兼容性能可以覆盖的情形,需由医疗器械检验机构在检测报告中提供相关说明。
(5)对于典型检品的选择,申请人应当提供相关资料予以证明。
(6)该产品进行电磁兼容检测时,根据GB4824归为B类设备,运行模式应尽量与临床典型应用一致。根据不同产品的功能差异,常见的运行模式示例如下:
正常运行模式:接收器和发射器无线连接后,发射器与葡萄糖传感器连接,传感器通过测试模拟的人体葡萄糖浓度或使用模拟传感器(电阻),按照正常工作的通信模式,接收器接收发射器发射的葡萄糖浓度数据,在接收器上实时显示。
充电模式(内部电池供电除外):通过适配器给设备充电。
待机模式:在正常运行模式以外,设备处于待机状态下。
数据下载模式:葡萄糖接收器通过数据线连接电脑,打开用户分析软件,读取和下载接收器中的数据。
其他模式(如有)。
3.产品性能研究
应当提供与产品性能及产品技术要求相适应的研究资料,应明确制定依据,所采用的标准、采用的原因及理论基础,以及标准不适用项目的合理解释。试验方法明确检测样本数量确定依据、检测设备、方法学。参考附件4明确性能指标的定义及计算公式。
联合使用:如申报产品预期与其他医疗器械、非医疗器械产品联合使用实现同一预期用途,如,配套使用的能够用于该产品校准的血糖仪,胰岛素泵、蓝牙适配器等,应当提供证明联合使用安全有效的研究资料,包括互联基本信息(连接类型、接口、协议、[敏感词]性能)、联合使用风险及控制措施、联合使用上的限制,兼容性研究等。
4.生物相容性评价研究
依据 GB/T16886.1标准要求开展生物学评价。按照具体产品的接触类型进行相应的评价,并应关注由于多次使用的累计效应。例如,传感器电极与组织持久接触,穿刺针与组织瞬时接触。胶布、发送器和电极连接座外壳、传感器基座与皮肤持久接触。
评价报告中应提供生物相容性测试报告摘要,包括部件名称、产品型号、试验项目、试验方法、参考标准、浸提介质、浸提比、浸提温度和时间、试验结果、报告号及提交位置。
按照GB/T 16886.9、GB/T 16886.16、GB/T 16886.17、GB/T 16886.18对可滤沥物、可溶出物、潜在降解产物进行分析。
参考药典等中测试方法对溶剂、交联剂残留量(如适用)进行测试或分析。
5.生物安全性研究
该产品尤其是传感器部分,若含有同种异体材料、动物源性材料或生物活性物质等具有生物安全风险类产品(常见的如牛血清白蛋白、人血清白蛋白),应当提供相关的研究资料及生物活性物质的生物安全性研究资料。采用人血清白蛋白的产品,应提供生物安全性检测报告。采用牛血清白蛋白的产品需按照动物源性医疗器械产品注册申报资料指导原则提供生物安全性研究资料。采用酶的产品可按照GB/T16886.20、YY/T1465.1提供生物安全性研究资料,或提供已有数据的评估资料。
6.灭菌工艺研究
根据灭菌方法的选择,明确产品的灭菌工艺(方法和参数)和无菌保证水平及其确定依据,并对残留毒性提供研究资料。
明确关键部分的灭菌工艺,如传感器部分怎样保证包装完整而达到灭菌效果,且传感器酶活性等不受影响。
7.稳定性研究
(1)货架有效期
参考无源植入性医疗器械稳定性研究指导原则2022年修订版提供货架有效期研究资料。
提供不同批次传感器有效期的验证报告。可以通过加速老化实验和/或实时老化实验相结合的方式验证有效期。应提供传感器性能稳定性的研究资料。
无菌初包装研究
说明在宣称的有效期内以及运输储存条件下,保持包装完整性的依据。可通过染色、密封强度、气泡试验、目测完整性试验、微生物屏障试验等验证包装完整性。
(2)使用稳定性
参考《有源医疗器械使用期限注册技术审查指导原则》,提供使用期限研究资料。
对于CGMS除传感器外的其他部分,若为有限次重复使用,应当提供使用次数验证资料。证明在申请人规定的使用期限/使用次数内,在正常使用、维护和校准(如适用)情况下,产品的性能功能满足使用要求。
(3)运输稳定性
参考GB/T14710《医用电器环境要求及试验方法》、ASTM D 4169-16《运输包装件性能测试规范》等标准,提供运输稳定性和包装研究资料,证明在生产企业规定的运输条件下,运输过程中的环境条件(例如:震动、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。
8.软件研究
软件安全级别为C级。软件研究需按照《医疗器械软件注册审查指导原则》、《医疗器械网络安全注册审查指导原则》、人工智能医疗器械注册审查指导原则(如适用)、《移动医疗器械注册技术审查指导原则》(如适用)的要求提交研究资料。
9.其他研究资料
研究资料应明确评价指标、接受标准、测试方法(样本量及制定依据、测试设备、测试步骤等)、数据分析方法、测试结果、测试结论。
提供持续葡萄糖传感器葡萄糖限制膜对葡萄糖浓度的控制原理的研究资料。分别测试酶电极(未涂葡萄糖限制膜)和涂膜后的传感器(在酶电极上加涂了葡萄糖限制膜)在葡萄糖溶液中的电流响应,并计算其线性相关系数和灵敏度。
提供过氧化氢反向渗透可能性研究资料(如适用)。提供氧气响应的研究资料(如适用)。
提供氢离子积聚导致组织液pH值变化对传感器性能影响的研究资料,包括线性、稳定性、pH值变化验证。线性观察在高浓度的葡萄糖体系下传感器相应的变化;稳定性试验宜在较高浓度葡萄糖体系中进行使用期限的稳定性测试,观察传感器性能变化;pH值变化验证观察测试前后测试体系中的pH值。
提供传感器在声称的佩戴天数中有无异体蛋白脱落带来免疫源问题的研究资料,可以提供已上市产品的免疫源性安全性评价资料。
在制造过程中,应提供批内差异及批间差异研究资料,应提供确保传感器性能在制造工艺中的一致性研究报告或经品质检验方法从而达到产品性能一致性的研究报告。应提供连续三批产品的线性、重复性、响应时间、稳定性、温度响应的检测报告。
提供传感器校准或者是免校准系统(工厂校准)控制的研究资料(见附件3)。
如产品适用于家用,应参照YY9706.111标准提供适宜家用的研究资料。
如适用,应提供无线设备符合无线电管理相关规定的支持性资料,应提供无线传输有效性的研究资料。
应用纳米材料的产品应按照《应用纳米材料的医疗器械安全性和有效性评价指导原则[敏感词]部分:体系框架》提供相关研究资料。
(四)产品说明书和标签样稿
产品使用说明书应符合《医疗器械说明书和标签管理规定》和相关的[敏感词]标准、行业标准的要求。此外应特别注意:
1.检测原理
说明书中应有对样本类型,佩戴部位和检测原理的说明,包括是检测组织液,还是血液中葡萄糖;采用电化学方法还是荧光方法,佩戴在上臂背侧还是腹部等的说明。
2.校准方法和有效使用时长
说明书中应包含用什么血糖值校准,及校准频率(如需校准),传感器最长使用时长等信息。
3.禁忌证(如有)
这部分内容应列出:在哪些情况下,[敏感词]不能使用设备。
如,磁共振环境不安全的说明。
4.警告/注意
基于可得到的信息,什么情况下风险会上升,效果会下降,或者在研究设计中,哪些没有被充分考虑(例如,包含/排除准则),这些因素应在本节中列出。如,干扰物可能影响检测准确度;传感器松动或脱出可能导致APP没有读数;传感器折断,请勿自行处理,请向专业医护人员寻求帮助。
5.使用指导
应当提供详细的指导,以反映在临床前及临床研究中获得的经验。
6.适用范围和条件
明确使用范围和条件,如若为家用,是否需要医生处方,或者是患者被培训到什么程度等条件。
7.电磁兼容信息
应包含YY0505/YY 9706.102标准中要求相关表格,指南和制造商的声明—电磁发射/电磁抗扰度及相关警示和条款。
说明书应包含靠近射频通信设备使用会影响CGMS正常工作的说明;
若CGMS存在无线传输功能,应列出非电离符号,使用说明书中应包含避免对周围设备产生有害电磁影响的指南;说明书中应列出发射器的发射频率或频带、调制类型和频率特性、有效辐射功率;接收器的接收频率、优选频率或频带、带宽(如适用);
部件若需更换时,应使用制造商规定的型号,否则可能会导致发射的增加或抗扰度性能的降低;
如含有数据线,说明书应给出制造商规定的型号和长度;若数据线含有磁环等元件,应给出使用注意事项;
含有免于静电放电试验的连接器,则应在使用说明书中列出静电放电警示符号和警示信息、预防静电放电的措施以及对可能使用这些信息的相关人员的培训建议。
明确产品的基本性能。
8.家庭环境使用
如产品是家用产品,使用说明书应简洁且易于理解。应提供关于如何安全处置废物的适当警告和注意事项。应提供器械的清洁/消毒方法,一般来说家用器械应使用易于获取的用品和简单的技术来清洁、消毒。应包含用户检查器械的损坏迹象,以及如何识别不能使用器械或其配件的情况。佩戴该产品游泳及淋浴的注册事项;该产品含有小部件,小孩如果吞咽有窒息危险的提示。
9.软件要求
应符合医疗器械网络安全注册审查指导原则、医疗器械软件注册审查指导原则、移动医疗器械注册技术审查指导原则中说明书的相关要求。
10.数字连接设备
应当明确联合使用设备信息,如经临床试验验证的的血糖仪、胰岛素泵、蓝牙适配器的制造商、型号/[敏感词]性能参数(如显示屏最小尺寸、分辨率、[敏感词]亮度、环境光、[敏感词]电池电量)等。应包括可能影响数字连接设备性能的传感器数据的可用性及与数字连接设备进行通信的说明。
11.潜在干扰物质的信息
应提供潜在干扰物质的信息,列出任何已确定会对传感器准确性造成干扰的被测化合物以及证明即使存在干扰物质临床性能也可接受的数据,可参考CLSI EP07文件。
12.临床试验信息
包括不限于目标人群、警示准确性、整个测量区间的系统性能准确性指标,不同人群、不同传感器植入部位的性能差异、每个预期使用人群的临床研究中观察到的不良事件等信息。
13.使用期限
各列明各组件的使用期限。
14.包含动物源性材料的产品,出于对患者知情权的考虑,需在产品说明书中明示出产品取材于何种动物的何种组织。
三、参考文献
[1]医疗器械注册与备案管理办法[Z].
[2]医疗器械说明书和标签管理规定[Z].
[3]医疗器械注册申报资料要求和批准证明文件格式[Z].
[4] 医疗器械产品技术要求编写指导原则[Z].
[5] 医疗器械软件注册审查指导原则(2022年修订版)[Z].
[6]医疗器械网络安全注册审查指导原则(2022年修订版)[Z].
[7]人工智能医疗器械注册审查指导原则[Z].
[8]移动医疗器械注册技术审查指导原则[Z].
[9] 血糖仪注册技术审查指导原则(2016年修订版)[Z].
[10]动物源性医疗器械注册技术审查指导原则(2017年修订版)[Z].
[11]无源植入性医疗器械稳定性研究指导原则2022年修订版[Z].
[12]应用纳米材料的医疗器械安全性和有效性评价指导原则[敏感词]部分:体系框架[Z].
[13]YY/T 0771.1 动物源医疗器械 第1部分:风险管理应用[S].
[14]GB/T 16886.1 医疗器械生物学评价 第1部分:风险管理过程中的评价与试验[S].
[15]GB/T16886.20 医疗器械生物学评价 第20部分:医疗器械免疫毒理学试验原则与方法[S].
[16]YY/T1465.1医疗器械免疫原性评价方法第1部分:体外T淋巴细胞转化试验[S].
[17]GB/T19634 体外诊断检验系统 自测用血糖监测系统通用技术条件[S].
[18]ISO 15197 In vitro diagnostic test systems —Requirements for blood-glucose monitoring systems for self-testing in managing diabetes mellitus[S].
[19] 贾伟平.持续葡萄糖监测.上海:上海科学技术出版社,2017:24-30.
[20]中华医学会糖尿病学分会.中国动态血糖监测临床应用指南(2012年版).中华糖尿病杂志,2012,4(10):582-590.
[21]中华医学会糖尿病学分会.中国血糖监测临床应用指南(2015年版).中华糖尿病杂志,2015,7(10):603-613.
[22]中华医学会糖尿病学分会.中国持续葡萄糖监测临床应用指南(2017年版).中华糖尿病杂志,2017,9(11):667-675.
[23] Parkes JL,Slatin SL,Pardo S,Ginsberg BH. A new consensus error grid to evaluate the clinical significance of inaccuracies in the measurement of blood glucose. Diabetes Care,2000,23(8):1143-1148.
[24] Zhou J,Lv X,Mu Y,Wang X,Li J,Zhang X,Wu J,Bao Y,Jia W. The accuracy and efficacy of real-time continuous glucose monitoring sensor in Chinese diabetes patients:a multicenter study. Diabetes Technol Ther,2012,14(8): 710-718.
[25] Zhou J,Zhang S,Li L,Wang Y,Lu W,Sheng C,Li Y,Bao Y,Jia W. Performance of a New Real-Time Continuous Glucose Monitoring System: A Multicenter Pilot Study. J Diabetes Investig. 2017 May 31.
[26] FDA. The Content of Investigational Device Exemption and Premarket Approval Applications for Artificial Pancreas Device Systems[EB/OL]https://www.fda.gov/media/80644/Download, 2012-11-9/2022-9-14.
[27]FDA.Design Considerations for Devices Intended for Home Use[EB/OL]https://www.fda.gov/media/77642/download, 2020-1-22/2022-3-8.
[28] Clinical and Laboratory Standards Institute (CLSI).Interference Testing in Clinical Chemistry; 3rd Edition. CLSI document EP07.
[29] Hoss U, Jeddi I, Schulz M, et al. Continuous glucose monitoring in subcutaneous tissue using factory-calibrated sensors: a pilot study[J]. Diabetes Technology & Therapeutics, 2010, 12(8):591.
[30] Guyton A, Hall J: Transport of oxygen and carbon dioxide in blood and tissue fluids. In: Textbook of Medical Physiology, 11th ed. Philadelphia: Elsevier Saunders, 2006: 502–513.
[31] Clinical and Laboratory Standards Institute (CLSI). Performance Metrics For Continuous Interstitial Glucose Monitoring, 2rd Edition.2020.
[32]FDA.Self-Monitoring Blood Glucose Test Systems for Over-the-Counter Use[EB/OL] https://www.fda.gov/media/87721/download,2020-9-29/2022-09-14.
[33] Hoeks LB,Greven WL,de Valk HW. Real-time continuous glucose monitoring system for treat ment of diabetes: a systematic review. Diabet Med,2011,28(4):386-394.
[34]Danne T, Nimri R, Battelino T, et al. International consensus on use of continuous glucose monitoring[J]. Diabetes Care,2017,40(12):1631⁃1640.
[35]attelino T, Danne T, Bergenstal RM, et al. Targets for
continuous glucose monitoring data interpretation:recommendations from the international consensus on time in range[J]. Diabetes Care,2019,42(8):1593⁃1603.
[36] Vashist SK.Continuous glucose monitoring systems: A review. Diagnostics (Basel),2013,3(4):385-412.
[37] Hoss U, Budiman E. Factory-Calibrated Continuous Glucose Sensors: The Science Behind the Technology[J]. Diabetes Technology & Therapeutics, 2017, S2 (19): S44.
[38] Clarke WL,Cox D,Gonder-Frederick LA,Carter W,Pohl SL. Evaluating clinical accuracy of systems for self-monitoring of blood glucose. Diabetes Care,1987,10(5):622-628.
附件:1.产品资料性附录
2.标准符合清单
3. CGMS产品技术要求模板
4.技术指标计算公式
5.免校准研究资料
6.抗干扰性
附件1
产品资料性
附录
一、产品分类
该产品根据有创程度分为植入式、微创式、无创式CGMS;植入式CGMS是将葡萄糖传感器通过临床干预全部植入人体皮下,进行持续葡萄糖监测;微创式CGMS是将葡萄糖传感器电极部分[敏感词]皮下,传感器其他部分置于人体外部,进行持续葡萄糖监测;无创式CGMS无需刺破皮肤即可进行持续葡萄糖监测,基于体表组织部位如舌头、口腔粘膜、及皮肤等对汗液、唾液、泪液中葡萄糖含量进行测试。
根据原理分成电化学类和光学类CGMS等。采用光学原理的CGMS是基于对葡萄糖敏感的荧光指示剂,通过荧光辐射在荧光指示剂上,收集反射回来的荧光信号,分析葡萄糖含量信息。采用电化学原理的CGMS,将葡萄糖传感电极经皮肤植入到皮下组织,通过对组织间液中葡萄糖浓度的检测,根据其与葡萄糖的相关性,测算葡萄糖浓度。
根据附加功能方式分为无附加功能、附加血糖/血酮/其他检测功能。
根据数据接口及准确度不同,分为传统CGMS和 iCGMS,iCGMS旨在可靠和安全地将葡萄糖测量数据传输到数字连接器械,且准确度应满足表1要求;iCGMS的数字连接器械可以是智能移动终端(手机或平板电脑)、胰岛素自动给药装置、手动控制的治疗仪器等。
根据数据提供方式分为实时式、回顾式及扫描式CGMS。实时式CGMS在使用过程中,能在[敏感词]时间显示出葡萄糖数据;回顾式CGMS在佩戴结束后将数据上传后才能获得葡萄糖数据;扫描式CGMS不能自动传输数据至监测器,需用户手动扫描获取数据。
根据校准方式可分为校准型、免校准型CGMS。校准型CGMS在使用过程中,需要使用者输入指尖测量血糖或其他血糖值进行校准,免校准型不需要使用者输入指尖测量血糖或其他血糖值进行校准。
二、iCGMS的准确度要求
表1iCGMS的准确度要求
| iCGMS测量范围 | 参考血糖值偏差 | 性能标准 | |
| 1 |
整个器械测量范围 (如,2.2-22mmol/L) |
±20%以内 | 单侧95%置信区间下限>87% |
| 2 | <3.9 mmol/L | ±0.83mmol/L以内 | 单侧95%置信区间下限>85% |
| 3 | <3.9 mmol/L | ±2.2mmol/L以内 | 单侧95%置信区间下限>98% |
| 4 | 3.9-10.0mmol/L | ±15%以内 | 单侧95%置信区间下限>70% |
| 5 | 3.9-10.0mmol/L | ±40%以内 | 单侧95%置信区间下限>99% |
| 6 | >10.0mmol/L/ | ±15%以内 | 单侧95%置信区间下限>80% |
| 7 | >10.0mmol/L | ±40%以内 | 单侧95%置信区间下限>99% |
| 8 | <3.9 mmol/L | 相应血糖值读数不应高于10.0mmol/L(i.e., 0%) | |
| 9 | >10.0mmol/L | 相应血糖值读数不应低于<3.9 mmol/L(i.e., 0%) | |
三、电化学原理传感器技术
根据电化学原理传感器技术区分,目前该技术已有3代,具体如下:
第1代工作原理:组织间液的葡萄糖与氧气和水经葡萄糖氧化酶反应生成过氧化氢,过氧化氢分解生成的电子被传感器铂电极所获取,形成可监测的持续性电流,通过算法换算可得葡萄糖值。
第2代工作原理:组织间液的葡萄糖经葡萄糖氧化酶反应生成电子并由葡萄糖氧化酶的辅酶或介体捕获,电子通过传感器电极上的电子介质传导到电极上,形成可监测的持续性电流,通过算法换算可得葡萄糖值。
第3代工作原理:组织间液的葡萄糖经用电子介质修饰或改性过的葡萄糖氧化酶反应生成电子并传导到电极上,形成可监测的持续性电流,通过算法换算可得葡萄糖值。
附件2
符合标准清单
表1符合标准清单示例
| 标准号 | 标准名称 | 备注 |
| GB 9706.1 | 医用电气设备 第1部分:基本安全和基本性能的通用要求 | |
|
YY 0505 或 YY 9706.102 |
医用电气设备 第1—2部分:安全通用要求 并列标准 电磁兼容 要求和试验 或 医用电气设备第1—2部分:基本安全和基本性能的通用要求并列标准:电磁兼容要求和试验 |
|
|
YY 0709 或 YY9706.108 |
医用电气设备 第1—8部分:安全通用要求 并列标准:通用要求 医用电气设备和医用电气系统中报警系统的测试和指南 或 医用电气设备 第1—8部分:基本安全和基本性能的通用要求 并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南 |
声明有报警功能时适用 |
| YY9706.111 |
医用电气设备第1-11部分:基本安全和基本性能的通用要求-并列标准:家庭医疗保健环境中使用的医用电气设备和医用电气系统的要求 英文 |
可在家庭中使用时适用 |
| GB/T 19634 | 体外诊断检验系统—自测用血糖监测系统通用技术要求 | 附加血糖模块时适用 |
| GB/T 4208 | 外壳防护等级(IP代码) | |
| GB15811 | 一次性使用无菌注射针 | |
| GB/T 18457 | 制造医疗器械用不锈钢针管 | |
| YY/T0148 | 医用胶带 通用要求 | |
| GB/T 14233.1 | 医用输液、输血、注射器具检验方法第1部分:化学分析方法 | |
| GB/T 14233.2 | 医用输液、输血、注射器具检验方法第2部分:生物学试验方法 |
附件3
CGMS产品
医疗器械产品技术要求编号
持续葡萄糖监测系统
1.产品型号/规格及其划分说明
1.1系统型号
1.2 产品信息(附录A)
2.性能指标
2.1外观
明确传感器、发射器、接收器部分各自的外观要求。
2.2传感器性能
2.2.1线性
明确传感器在有效使用时间内对体外模拟葡萄糖溶液浓度的测量范围。
明确传感器所产生的信号相对于模拟葡萄糖溶液浓度的线性相关系数和线性偏差。
2.2.2重复性
明确单个传感器的重复性,以传感器测量模拟葡萄糖溶液所产生的信号的变异系数表示。明确重复次数及数据读取时间。所使用的模拟葡萄糖溶液至少3个浓度:小于3.9mmol/l、3.9-10.0 mmol/l、大于10.0 mmol/l。
2.2.3响应时间
明确体外模拟葡萄糖溶液浓度变化时,传感器输出结果达到稳定所需的时间范围。稳定是指可传出有效葡萄糖数据。响应时间是指传感器从被激活开始,直至可传出有效葡萄糖数据的时间。
2.2.4稳定性
明确传感器在寿命时长运行过程中,在高浓度葡萄糖测试条件下(大于10 mmol/L),体外信号每24小时的变化范围。
2.2.5温度响应
明确在不同的温度下,传感器的线性偏差的范围。温度范围可由企业自定义。
2.2.6 传感器的抗干扰性
依据说明书,明确系统对常见药品(如抗坏血栓和醋氨酚等)的抗干扰的能力。具体要求件附件4。
2.2.7启动时间
明确从传感器[敏感词]模拟葡萄糖溶液,并连接到发射器后,系统显示[敏感词]个数据点所需的时间与传感器连接到发射器的时间。
2.2.8传感器机械要求
明确传感器机械要求,如电极连接牢固度、传感器与发射器间[敏感词]力(如适用)、导引针穿刺力(如适用)、导引针针座拉力、针座传感器电极基座拔出力、传感电极本身抗拉力、传感器电极刺入后的拉出力、导引针回缩功能、柔性传感电极弯曲疲劳。
2.2.9传感器与发射器的连接
明确连接力(如适用)、连接电阻、持续性、锁定力(如适用)、防水性能。
2.2.10传感器物理设计
明确传感器物理设计要求,如导引针尺寸、电极长度/宽度/厚度、植入人体深度、电极角度、旋转稳定性(如适用)、连接兼容性、安放面积、导引针防护、导引针长度。
2.2.11传感器生物性能
2.2.11.1传感器应无菌。
2.2.11.2传感器细菌内毒素每件应不超过20EU/套。
2.2.12传感器化学性能
明确检验液、空白液制备、酸碱度、重金属总含量、环氧乙烷残留量(如适用)要求。
2.2.13传感器终产品免疫原性
明确通过体外试验测定的能够间接地反映产品免疫原性得到有效控制的终产品的性能指标,例如残留DNA含量、残留抗原含量、残留杂蛋白含量等(基于风险分析,根据不同情况选择适宜的指标)。
2.3发射器/接收器性能
2.3.1发射器防水性能(如适用)
明确发射器防水性能等级(如,IP48),并应符合GB4208-2017标准相关防水要求。
2.3.2发射器或接收器等记录原始数据的准确性(如适用)
明确有效使用时间内宣称测量范围内的准确性。
2.3.3发射器的线性相关系数
明确发射器的线性相关系数。
2.3.4发射器/接收器的电池性能
明确与传感器一起使用的发射器/接收器电池寿命,充电功能等。
2.3.5射频要求
明确传输距离。
2.3.6发射器配对要求
明确发射器与显示终端的一对一或一对多的配对要求。
2.3.7系统兼容性
明确多个CGMS(给出具体数量,如15个)近距离工作时,不会导致数据串扰。
2.4操控性
按键、连接结构应灵活可靠,操作方便。
2.5 移动医疗设备运行条件
明确软件正常运行所需的典型运行环境,包括硬件配置(含处理器、存储器、外设器件)、外部软件环境(列明全部软件的名称、完整版本、补丁版本,使用“兼容版本”而非“以上版本”、“更高版本”)、网络条件(含网络架构、网络类型、网络带宽),涵盖客户端、服务器端(若适用)、云端(若适用)要求。无需重复描述必备软硬件。
2.6软件功能
依据说明书明确软件功能,如接收器软件功能,包括患者事件输入(参比血糖输入、记录胰岛素用量、记录饮食、记录用药、记录锻炼)、传感器开关、血糖回顾、基本设置、医生设置、当前电流。
2.7提示功能
包括不限于:指示灯、输入参比血糖的提示、数据处理器电量不足提示、数据采集器电量不足提示、通信异常提示、信号异常提示、提示的确认和清除、阈值提醒功能(当传感器监测的葡萄糖浓度高于或低于CGMS软件设置的阈值时,在预定设置的时间窗内可向用户发出提示)。
2.8葡萄糖趋势预测功能
(明确趋势分类,如平缓、缓慢增加、缓慢减少、快速增加、快速减少,可采用平均速率偏差和平均[敏感词]速率偏差指标应用一致性矩阵方式测试趋势准确性。
2.9网络安全要求
2.9.1数据接口
明确软件供用户调用的应用程序接口(API)、数据接口(含传输协议、存储格式,如DICOM、HL7、JPG、PNG、私有协议与格式)、产品接口(可联合使用的其他医疗器械独立软件、医疗器械硬件产品)。
2.9.2用户访问控制
明确软件的用户身份鉴别方法、用户类型及用户访问权限。
2.10附件要求
2.10.1医用胶布
应明确有效使用时间内医用胶布持粘性及剥离强度。可参考YY/T 0148-2006标准中要求。
2.10.2 引导针性能
针头、针管刚性、韧性、耐腐蚀、连接牢固度、化学性能(如酸碱度、重金属、环氧乙烷残留量(如适用))
2.10.3 其他附件
2.11安全
系统应符合GB9706.1-2020、YY0709—2008/ YY9706.108-2021(如声称)标准中的要求。产品安全特征参照附录A。
如适用,医用级别充电器应符合 GB9706.1-2020标准要求。
2.12电磁兼容
应符合YY 0505-2012/YY 9706.102-2021标准的要求。
3. 检验方法
工作条件:明确系统的工作条件,如额定工作电压,环境条件(如相对温、湿度等)等。
如适用,应明确模拟葡萄糖溶液成分(附录C)及自研检测用设备信息(附录D)。
……
(分页)
附录
产品信息
产品配置表
表1产品配置表示例
|
部件 名称 |
部件 型号 |
参数 |
实物图/示意图/ 拆解图 |
型号1/ 配置1 |
型号2/ 配置2 |
| 基本组成 | |||||
| 传感器 |
有效工作时间、 校准次数、 X分钟显示一个数据、 电极数量、一次性无菌产品、 葡萄糖浓度探测范围 |
√ | √ | ||
|
发射 器1 |
电池类型、容量 | √ | √ | ||
| 接收器1(如有) | √ | ||||
|
接收器2 (如有) |
√ | ||||
| 软件1 | 运行环境 | √ | |||
| 软件2 | 同上 | √ | |||
| 附件(如有) | |||||
| 助针器 | √ | √ | |||
| 充电器 | √ | √ | |||
| 传感器电极检测器 | √ | √ | |||
| 胶布 | √ | √ | |||
注:应明确不同规格部件差异(如有);√表示配置中包含该部件
2.传感器电极结构及化学堆层
2.1提供传感器电极剖面放大图,描述各电极(如:工作电极、参比电极、对电极)结构。
2.2传感器电极化学堆层示意图及必要中文注释,结合制造工艺明确各膜层溶液成分、规格。
3.软件
3.1软件名称
3.2软件发布版本
3.3软件完整版本命名规则
4.与人体接触材料
表2与人体接触材料
| 编号 | 部件名称 |
材料名称 (含化学名称) |
规格型号 | 符合标准 | 接触部位 | 接触类型 |
注:与人体接触材料应结合图示注明
5.灭菌方式
辐射灭菌明确射线束类型
6.灭菌有效期
附录B 产品安全特征
附录
附录
附件4
技术指标中术语及计算公式示例
一、线性
该条款旨在考量传感器在宣称测量范围内,产生的信号与模拟葡萄糖溶液浓度之间的线性关系和线性偏差。
线性相关系数:
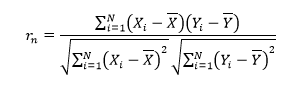
其中,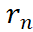 表示第n个传感器的线性相关系数n=1,2,3…
表示第n个传感器的线性相关系数n=1,2,3…
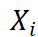 表示第i个葡萄糖浓度值,i=1,2,3…
表示第i个葡萄糖浓度值,i=1,2,3…
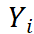 表示第i个响应电流值,i=1,2,3…
表示第i个响应电流值,i=1,2,3…
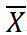 表示葡萄糖浓度平均值
表示葡萄糖浓度平均值
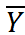 表示响应电流平均值
表示响应电流平均值
N表示葡萄糖浓度数
线性偏差: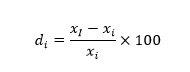
其中,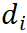 表示该传感器第i个葡萄糖浓度的线性偏差, i=1,2,3…
表示该传感器第i个葡萄糖浓度的线性偏差, i=1,2,3…
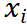 表示第i个葡萄糖浓度值,i=1,2,3…
表示第i个葡萄糖浓度值,i=1,2,3…
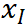 表示在第i个葡萄糖浓度下测试得出的响应电流值代入线性回归方程y=ax+b计算得出的葡萄糖浓度值。
表示在第i个葡萄糖浓度下测试得出的响应电流值代入线性回归方程y=ax+b计算得出的葡萄糖浓度值。
二、重复性
该条款旨在考量单个传感器在短时间内测量的重复性。
标准差SD:
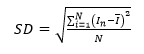
其中,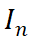 表示同一浓度下第n次电流值,n=1,2,3
表示同一浓度下第n次电流值,n=1,2,3
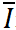 表示同一浓度下响应电流平均值
表示同一浓度下响应电流平均值
N表示响应电流样本值
变异系数CV: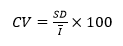
其中,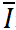 表示同一浓度下响应电流平均值
表示同一浓度下响应电流平均值
三、响应时间
该条款旨在考量传感器对模拟葡萄糖溶液浓度变化的响应。
稳定是指可传出有效葡萄糖数据。响应时间是指传感器从被激活开始,直至可传出有效葡萄糖数据的时间。
四、稳定性
该条款旨在考量传感器在整个使用寿命范围内的稳定性。
响应电流值变化率: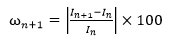
其中,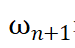 表示第n+1天响应电流值变化率n=1,2,3…
表示第n+1天响应电流值变化率n=1,2,3…
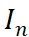 表示第n天响应电流值n=1,2,3…
表示第n天响应电流值n=1,2,3…
N天平均每24h的电流变化率: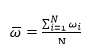
其中,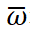 表示N天平均每24h响应电流变化率
表示N天平均每24h响应电流变化率
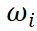 表示第i天的响应电流变化率i=1,2,3…N表示测试天数
表示第i天的响应电流变化率i=1,2,3…N表示测试天数
五、温度响应
该条款旨在考量模拟人体体温变化时,传感器的性能变化。
六、 传感器的抗干扰性
该条款旨在考量某些药物成分等对于传感器性能的干扰。
七、启动时间
启动时间是指从传感器[敏感词]模拟葡萄糖溶液,并连接到发射器后,系统显示[敏感词]个数据点所需的时间与传感器连接到发射器的时间差。
启动时间=显示[敏感词]个数据点的时间-传感器连接到发射器的时间。
八、发射器的线性相关系数
附件5
免校准研究资料
一、概述
以电化学为基本原理的CGMS,在测量组织间液葡萄糖浓度时通常需要校准。
校准是指将传感器监测到的电流型号转化为血糖信号的过程,传感器的灵敏度代表校准因子,用于将传感器电响应转换为血糖值(从校准时间点开始)。校准过程需要用户进行每日血糖( Blood Glucose,BG)测试,传感器对血糖的灵敏度可以根据一个传感器的电流值及其相应的时间匹配BG读数计算得到。校准过程有几个缺点,首先是增加用户的使用负担,每次校准都需要痛苦和耗时的BG测试;其次用户校准过程的不规范影响BG测试的准确度,从而影响传感器系统的准确性。
对于免校准产品,申报企业应描述产品免校准的原理及实现方法,并设计评估指标及评估方法进行验证,评价免校准CGMS的性能。
二、评价方法
(一)试验原理
申报企业应描述产品免校准的原理及关键因素,比如:
实现传感器免校准(或称“工厂校准”)的基本原理是根据传感器在体外测试的灵敏度来预测其在患者体内佩戴的灵敏度,并且在佩戴期间,传感器的灵敏度保持相对稳定。为了实现免校准,产品应满足如下几个条件:
1.传感器具备批次生产一致性,即经工厂校准的同一批次传感器灵敏度应保持一致;
2.传感器体外测试灵敏度与体内实际灵敏度存在高度相关性,可根据体外灵敏度准确预测体内灵敏度;
3.传感器在使用期间保持灵敏度相对稳定,或灵敏度可预测、或者其变化可被识别,不出现无规律性的灵敏度变化;
4.传感器在灭菌前后及货架寿命期间,灵敏度保持相对稳定或灵敏度可预测、或者其变化可被识别。
(二)试验设计
申报企业应基于产品免校准原理,设计评价指标及评价方法,如:
1.传感器灵敏度批次生产一致性测试
基于批次工厂校准技术,应评估同一批次生产的传感器灵敏度一致性,以批内传感器灵敏度的变异系数(CV)为评价指标。
基于单个产品校准技术,进行工厂校准的集成式传感器,应提供多个批次的传感器的工厂校准参数和传感器在三个不同浓度的葡萄糖溶液中的灵敏度研究资料。
测定灵敏度时,应评估至少3个不同浓度血糖下传感器电流响应的稳定性,包括低浓度血糖(小于3.9 mmol/L)、中浓度血糖(3.9-10.0mmol/L)和高浓度血糖(大于10.0mmol/L)。检测环境的温度应保持在37±1℃。
2.传感器在体内外灵敏度相关性测试
设计预临床试验,纳入受试者佩戴传感器进行试验,测定传感器体外测试灵敏度与体内实际灵敏度之间的相关系数。
传感器在体内的灵敏度通过采集受试者指尖血血糖值,并记录同一时刻下传感器的电流响应值来计算。佩戴时间为产品预期使用时间,每天至少采集3次指尖血血糖值用于计算体内灵敏度。体内灵敏度取产品预期使用时间内多日测试的灵敏度均值。
传感器在体外的灵敏度测试方法与上述“传感器灵敏度批次生产一致性测试”相同。
3.传感器在佩戴期间的体内灵敏度分析
应通过体外模拟测试及体内测试,评估传感器在宣称使用时间内,在体内环境下灵敏度的稳定性、可预测性或变化可识别性,测试方法应进行时间冗余设计。
(1)模拟测试
应在模拟体内组织间液的检测环境下,评估至少3个不同浓度血糖下传感器电流响应的稳定性或变化趋势,包括低浓度血糖(小于3.9 mmol/L)、中浓度血糖(3.9-10.0mmol/L)和高浓度血糖(大于10.0mmol/L)。
模拟体内组织间液的成分见表1,检测环境的温度应保持在37±1℃,氧含量应保持在2-5%。
(2)体内测试
设计预临床试验,纳入受试者佩戴传感器,通过采集受试者指尖血血糖值,并记录同一时刻下传感器的电流响应值,评估传感器在体内环境下的灵敏度稳定性或变化趋势。如灵敏度变化趋势有较强一致性,应描述算法对该趋势的应对策略,并通过预临床实验的算法模拟分析进行验证;如灵敏度变化趋势一致性不明显,应描述算法识别该变化趋势的方式以及相应的应对策略,并通过预临床实验的算法模拟分析进行验证。
4.传感器在灭菌前后及货架寿命期间,灵敏度保持相对稳定、或灵敏度可预测、或者其变化可被识别。
应采用实时老化的方法,评估传感器在灭菌前后、预期储存条件及使用期限内灵敏度变化。申报企业应定义评价时间点,并提供依据。
(三)接收准则
申报企业应明确在“试验设计”中各项测试指标的接收准则,并提供依据,如:
1.传感器灵敏度批次生产一致性测试
同一批次内传感器灵敏度的变异系数(CV)应不超过5%。
2.传感器在体内外灵敏度相关性测试
传感器在体内外灵敏度应具有高度相关性,比如,二者为线性关系,其线性相关系数R2不低于0.95。
3.传感器在佩戴期间的体内灵敏度分析
若传感器在佩戴期间的体内灵敏度相对稳定,可参考如下标准:
(1)模拟测试:电流响应的平均变化率不超过5%;
(2)体内测试:传感器灵敏度的均值变化不超过5%。
若传感器在佩戴期间的体内灵敏度发生较大变化,因分析变化趋势。如变化趋势有较强一致性(例如灵敏度持续匀速降低,发生概率大于85%),应描述算法对该趋势的应对策略,并通过预临床实验的算法模拟分析进行验证;如趋势一致性不明显,应描述算法识别该变化趋势的方式以及相应的应对策略,并通过预临床实验的算法模拟分析进行验证。
4.传感器在在灭菌前后及有效期内灵敏度分析
若传感器灵敏度较为稳定,则灭菌前后灵敏度均值变化不超过5%;在有效期内灵敏度均值变化不超过2.5%/年。
若传感器在佩戴期间的体内灵敏度发生较大变化,则因分析变化趋势,接受准则参考“传感器在佩戴期间的体内灵敏度分析”要求。
(四)样品准备
1.传感器灵敏度批次生产一致性测试
应采用连续三批生产的传感器或传感电极或传感电极与发射器整机作为样品进行测试,明确每批次测试选取的样本量及制定依据。
2.传感器在体内外灵敏度相关性测试
对于体内灵敏度测试,应采用连续三批生产的传感器进行测试,明确每批次测试选取的样本量及制定依据。
对于体外灵敏度测试,应采用连续三批生产的传感电极或传感器进行测试,明确每批次测试选取的样本量及制定依据。
3.传感器在佩戴期间的体内灵敏度分析
(1)模拟测试:应采用同一批次生产的传感电极或传感器进行测试,明确每批次测试选取的样本量及制定依据;
(2)体内测试:应采用同一批次生产的传感器进行测试,明确每批次测试选取的样本量及制定依据。
4.传感器在有效期内灵敏度稳定性测试
应采用同一批次生产的传感器进行测试,明确每批次测试选取的样本量及制定依据。
三、数据分析
(一)传感器灵敏度批次生产一致性
计算同一批次内各传感器的灵敏度数值,分别计算每一批次内传感器灵敏度的变异系数,结果应满足“接收准则”的要求。
(二)传感器在体内外灵敏度相关性
分别计算测试样品在体内及体外的灵敏度,以体外灵敏度为横坐标、体内灵敏度为纵坐标绘图,通过线性拟合计算线性相关系数,结果应满足“接收准则”的要求。
(三)传感器在佩戴期间的体内灵敏度分析
若传感器在佩戴期间的体内灵敏度相对稳定,则应依照测试进行分析:
1.模拟测试:以测试时间为横坐标、响应电流为纵坐标绘图,并计算各样品在测试时间内响应电流的平均变化率,结果应满足“接收准则”的要求;
2.体内测试:以测试时间为横坐标、体内灵敏度为纵坐标绘图,并计算各样品在测试时间内,每一天的体内灵敏度均值,均值的变化应满足“接收准则”的要求。
若传感器灵敏度变化趋势有较强一致性(例如持续匀速降低,发生概率大于85%),应描述算法对该趋势的应对策略,并通过预临床实验的算法模拟分析进行验证;若传感器灵敏度变化趋势一致性不明显,应描述算法识别该变化趋势的方式以及相应的应对策略,并通过预临床实验的算法模拟分析进行验证。灵敏度变化的验证结果应满足“接收准则”的要求。
(四)传感器在有效期内灵敏度稳定性
以测试时间为横坐标、灵敏度为纵坐标绘图,并计算各样品在测试时间内,每一评价时间点的灵敏度均值,均值的变化应满足“接收准则”的要求。
四、研究报告
研究报告至少应包括以下内容,表格可参考表2-表5:
(一)传感器灵敏度批次生产一致性
列出连续三批生产的传感器或传感电极样品的灵敏度,以及批内样品灵敏度的变异系数;
(二)传感器在体内外灵敏度相关性
以体外灵敏度为横坐标、体内灵敏度为纵坐标绘图,分析传感器在体内外灵敏度相关性,计算相关性系数;
(三)传感器在佩戴期间的体内灵敏度分析
1.模拟测试:以测试时间为横坐标、响应电流为纵坐标绘图,并列表展示各样品在测试时间内响应的波动变化的上下限值、变化率及平均变化率;
2.体内测试:以测试时间为横坐标、体内灵敏度为纵坐标绘图,并列表展示各样品在测试时间内,每一天的体内灵敏度及均值。
若传感器灵敏度变化趋势有较强一致性,应描述算法对该趋势的应对策略,并提供预临床实验的算法模拟分析验证报告;若传感器灵敏度变化趋势一致性不明显,应描述算法识别该变化趋势的方式以及相应的应对策略,并提供预临床实验的算法模拟分析验证报告。
(四)传感器在灭菌前后及有效期内灵敏度稳定性
以测试时间为横坐标、灵敏度为纵坐标绘图,并列表展示各样品在测试时间内,每一评价时间点的灵敏度及均值。若灵敏度变化较大,应描述算法对该变化的识别方式及应对策略,并提供预临床实验的算法模拟分析验证报告。
表1 模拟组织液的成分
| 溶质 | 浓度 |
| NaH2PO4-H2O | 1.90 mmol/L |
| Na2HPO4-12H2O | 8.10 mmol/L |
| NaCl | 138 mmol/L |
| KCl | 2.7 mmol/L |
| 乙二胺四乙酸 |
1mmol/L (添加HCl或NaOH调节pH值为7.4) |
| 牛血清白蛋白 | 22 mg/mL |
可
注:模拟组织液的成分根据产品设计调整,应提供制定依据。
表2 传感器灵敏度及CV值
| 样品序号 |
批号1 灵敏度 |
批号2 灵敏度 |
批号3 灵敏度 |
| 1 | |||
| 2 | |||
| 3 | |||
| 4 | |||
| 5 | |||
| 6 | |||
| 7 | |||
| 8 | |||
| 9 | |||
| 10 | |||
| CV值 |
表3 传感器在模拟测试条件下的响应电流情况
| 样品序号 | 响应电流最小值 | 响应电流最小值 | 变化率 | 平均变化率 |
| 1 | ||||
| 2 | ||||
| 3 | ||||
| 4 | ||||
| 5 | ||||
| 6 | ||||
| 7 | ||||
| 8 | ||||
| 9 | ||||
| 10 |
表4 传感器在体内测试条件下的灵敏度情况
| 样品序号 | 第1天 | 第2天 | …… | 第n天 |
| 1 | 灵敏度1 | 灵敏度2 | …… | 灵敏度n |
| 2 | ||||
| 3 | ||||
| 4 | ||||
| 5 | ||||
| 6 | ||||
| 7 | ||||
| 8 | ||||
| 9 | ||||
| 10 | ||||
| 灵敏度均值 | 第1天均值 | 第2天均值 | …… | 第n天均值 |
注:表中的n为申报企业声称的产品最长可持续监测时间。
表5 传感器货架寿命有效期内的灵敏度情况
| 样品序号 | 评价时间点1 | 评价时间点2 | …… | 评价时间点n |
| 1 | 灵敏度1 | 灵敏度2 | …… | 灵敏度n |
| 2 | ||||
| 3 | ||||
| 4 | ||||
| 5 | ||||
| 6 | ||||
| 7 | ||||
| 8 | ||||
| 9 | ||||
| 10 | ||||
| 灵敏度均值 | 时间点1均值 | 时间点2均值 | …… | 时间点n均值 |
注:表中的评价时间点为申报企业拟定,应提供合理依据。
附件
抗干扰性
一、概述
CGMS在测量组织间液葡萄糖浓度时,可能受某些化学物质的干扰而影响其测量准确度,这些化学物质被称为“干扰物”。通常情况下,这些干扰物被分为内源性干扰物和外源性干扰物两种类别。内源性干扰物是指在人体内自发形成的、对产品分析或测量结果造成干扰的物质;外源性干扰物是指从体外摄入的(如药物、药物代谢产物及其他营养物质)、对产品分析或测量结果造成干扰的物质。
干扰物的作用机制通常包括电化学干扰、化学干扰及物理干扰等。其中,电化学干扰是指在CGMS工作过程中,因工作电极上施加了较高的氧化电位,电化学活性分子等干扰物被氧化产生干扰电流,这些干扰电流会对产品获取葡萄糖分子发生电化学反应产生的信号电流造成干扰,进而影响产品测量的准确性。化学干扰通常是由于干扰物抑制了监测过程中的化学反应,或是通过络合、沉积等方式改变被测物的形态,从而影响产品测量的准确性。物理干扰则是由于干扰物改变了测样本的物理状态,如粘度、表面张力、浑浊度、离子强度等,进而对产品测量准确性造成影响。
制造商应根据其产品的工作原理和作用机理,选择并评估常见干扰物对产品测量准确性的影响。制造商应构建模拟组织间液的测试环境,采用比对法进行测试,评价CGMS的抗干扰性能。
二、评价方法
(一)试验设计
制造商应在模拟体内组织间液的检测环境下,评估至少3个不同浓度血糖情况下产品的抗干扰性能,包括低浓度血糖(小于3.9 mmol/L)、中浓度血糖(3.9-10.0 mmol/L)和高浓度血糖(大于10.0 mmol/L)。
模拟体内组织间液的成分见附表1,检测环境的温度应保持在37±1℃,氧含量应保持在2-5%。在读数前,CGMS至少应在组织间液中浸润30-60分钟,以确保产品到达稳定状态。
附表2列举了人体血液中影响葡萄糖监测准确性的常见干扰物,制造商应基于风险管理来识别可能对产品测量准确性造成影响的干扰物。
建议采用比对法进行试验,即通过比对含有干扰物的模拟组织液样本(以下称“干扰物样本”)与对照样本的测量结果,评价产品的抗干扰性。干扰物样本与对照样本的葡萄糖浓度值,应通过标准实验室测量方法来确定。
(二)接收准则
当检测结果达到如下任一情况时,表明产品性能受干扰物影响,制造商应在说明书中载明干扰物的相关信息:
1.在低浓度血糖(小于3.9 mmol/L)的测试样本中,产品测量干扰物样本与对照样本的平均差值大于0.39 mmol/L;
2.在中浓度血糖(3.9-10.0 mmol/L)和高浓度血糖(大于10.0 mmol/L)的测试样本中,产品测量干扰物样本与对照样本的平均差值大于10%。
(三)样品准备
制造商可按如下程序准备6份样本:
1.分别配置低、中、高浓度血糖的模拟组织液各2份;
2.在其中一份模拟组织液中加入特定浓度的干扰物,作为干扰物样本;
3.在另一份模拟组织液中加入等体积溶剂,作为对照样本。
三、评价程序
每一样本在测量前应轻柔但充分混匀。具体操作步骤举例如下:
(一)使用EKF乳酸/葡萄糖分析仪或Yellow Spring Instrument(YSI)测量2次,计算平均值;
(二)使用同一批生产的至少10个CGMS进行测量,每个产品至少读 7 次,计算平均值;
(三)使用另一批生产的至少10个CGMS进行测量,每个产品至少读 7 次,计算平均值;
(四)使用第三批生产的至少10个CGMS进行测量,每个产品至少读 7 次,计算平均值;
(五)产品测量结束后,使用EKF乳酸/葡萄糖分析仪或YSI测量2次,计算平均值;
(六)比较步骤a)和e)所测量的参考值,以确保在评价过程中组织液样本无变化。如果结果超出预先规定的要求(即[敏感词]次结果和最后一次结果之问的差异在低血糖浓度(<3.9mmol/L)时>0.18 mmol/L;或在中、高血糖浓度(>3.9mmol/L)时≥4%,那么这个样本的测量值将不被应用,需使用另一样本重新进行测量。
四、数据分析
分析每个样本的测量数据,按照下列要求进行分析。具体操作步骤如下:
(一)对于每一样本,计算CGMS测量值的平均值及标准差;
(二)计算干扰物样本和对照样本测量结果平均值的偏差,若偏差达到2.2的接受标准,则表明产品性能受干扰物影响,应开展剂量-响应评估试验;
(三)剂量-响应评估试验:取干扰物在体内生理浓度的3倍值为[敏感词]浓度值,取[敏感词]浓度值的0%、25%、50%、75%和100%为测试剂量,分别重复“三、评价程序”的操作步骤进行测试。测试完成后,以干扰物剂量为横坐标,以干扰物样本和对照样本的偏差值为纵坐标,绘制偏差值-干扰物浓度曲线。
五、研究报告
研究报告至少应包括以下内容,表格格式可参考附表3:
列出已进行测试的干扰物及其浓度,以及选择依据;
对于附表2中未进行测试的干扰物,应说明理由;
(三)抗干扰性研究的主要结果及结论,包括:干扰物测试浓度、每一份样本的葡萄糖测量标准值、偏差值-干扰物浓度曲线。
表1 模拟组织液的成分示例
| 溶质 | 浓度 |
| NaH2PO4-H2O | 1.90 mmol/L |
| Na2HPO4-12H2O | 8.10 mmol/L |
| NaCl | 138 mmol/L |
| KCl | 2.7 mmol/L |
| 乙二胺四乙酸 |
1mmol/L (添加HCl或NaOH调节pH值为7.4) |
| 牛血清白蛋白 | 22 mg/mL |
注:模拟组织液的成分可根据产品设计调整,应提供制定依据。
表2 常见干扰物及推荐测试浓度
| 干扰物名称 | 推荐测试浓度 | |
| 中文 | 英文 | |
| 对乙酰氨酚 | Acetaminophen | 20 mg/dL |
| 抗坏血酸 | Ascorbic acid | 6 mg/dL |
| 结合胆红素 | Conjugated Bilirubin | 50 mg/dL |
| 游离胆红素 | Unconjugated Bilirubin | 40 mg/dL |
| 胆固醇 | Cholesterol | 500 mg/dL |
| 肌酸酐 | Creatinine | 15 mg/dL |
| 多巴胺 | Dopamine | 0.09 mg/dL |
| 乙二胺四乙酸* | EDTA* | 0.1 mg/dL |
| 半乳糖 | Galactose | 60 mg/dL |
| 龙胆酸 | Gentisic acid | 1.8 mg/dL |
| 还原型谷胱甘肽 | Reduced Glutathione | 4.6 mg/dL |
| 血红蛋白 | Hemoglobin | 1000 mg/dL |
| 肝磷脂* | Heparin* | 300 IU/dL |
| 布洛芬 | Ibuprofen | 50 mg/dL |
| 左旋多巴 | L-Dopa | 0.75 mg/dL |
| 麦芽糖 | Maltose | 480 mg/dL |
| 甘露醇 | Mannitol | 1800 mg/dL |
| 甲基多巴 | Methyldopa | 2 mg/dL |
| 水杨酸 | Salicylic acid | 60 mg/dL |
| 钠 | Sodium | 180 mmol/L |
| 甲苯磺丁脲 | Tolbutamide | 72 mg/dL |
| 甲磺吖庚脲 | Tolazamide | 9 mg/dL |
| 甘油三酯 | Triglycerides | 1500 mg/dL |
| 尿酸 | Uric acid | 23.5 mg/dL |
| 木糖 | Xylose | 600 mg/dL |
| 糖醇** | Sugar Alcohols** | 0.09 mg/dL |
注:*表格中乙二胺四乙酸和肝磷脂的浓度,是指其作为药物治疗的浓度,而非作为抗凝剂的浓度。
**指所有糖醇,包括但不限于山梨醇(sorbitol)、木糖醇(xylitol)、乳糖醇(lactitol)、异麦芽酮糖醇(isomalti)、麦芽糖醇(maltitol)等,制造商应分别采用这些物质进行产品抗干扰测试。
表3推荐报告表格式
| 干扰物 | 平均葡萄糖浓度(金标准) | 干扰物浓度(mg/dL) | 对照样本测量结果均值 | 干扰物样本测量结果均值 |
偏差 (mg/dL) |
偏差(%) | 置信区间 |
| 对乙酰氨酚 | 60 mg/dL | 20 mg/dL | |||||
| 120 mg/dL | 20 mg/dL | ||||||
| 250 mg/dL | 20 mg/dL |