发布人:管理员 发布时间:2022-08-17
Q1、什么是医疗器械的生物相容性,它是否适用于我的设备?
首先,生物相容性是指通过测试来确定 "设备的组成材料与人体接触后可能产生的不可接受的不良生物反应"。
例如,医疗设备不应该直接或通过其化学成分的释放,造成局部或全身的不良影响。局部影响可能包括皮肤刺激或烧伤,而全身影响可能包括疾病,如癌症、生殖系统影响或发育影响。
生物相容性的指导标准是ISO 10993,FDA已经发布了一份指导文件,概述了医疗设备开发商应如何应用ISO 10993。与历史上相比,FDA和ISO标准应用于生物相容性的一个不同之处是强调基于风险的方法。
设备制造商必须首先花时间了解他们的设备,以及它们如何与身体互动,以确定风险因素所在。传统上,仅仅通过检查清单的测试是可以接受的。现在,FDA非常坚持测试要有正当理由,并与风险相关。
Q2、我需要做生物相容性测试吗?
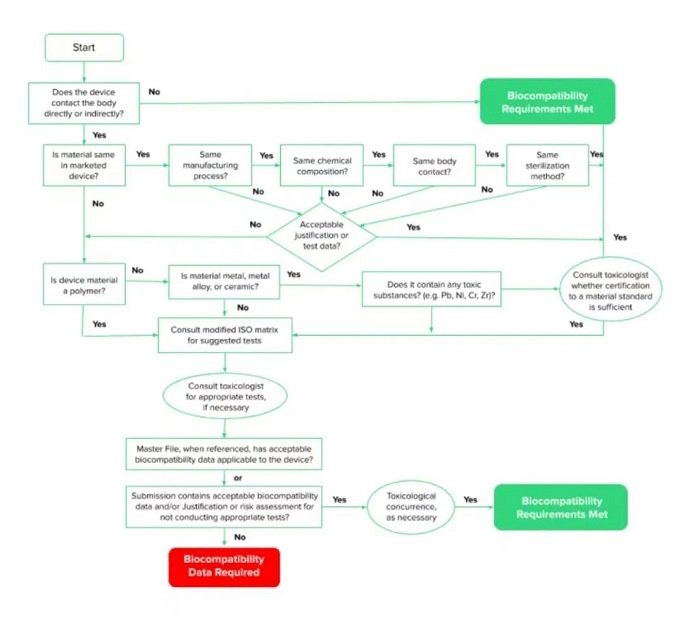
简单地说,与人体组织接触的医疗设备几乎总是需要进行生物相容性测试。ISO材料生物相容性矩阵可以帮助你确定你的设备是否需要测试。
然而,如果你提供足够的测试理由,并拥有以下任何或所有类型的数据,你可以减少所需的测试数量,甚至完全取消测试。
● 以前提交的数据。如果你使用的材料与以前测试的材料基本相同,你可能不需要做进一步的测试。如果有任何重大变化,如消毒方法、制造工艺、与病人接触的性质、材料的化学成分或材料的选择,那么可能需要进行确认性测试。
● 来自正在使用的材料供应商的数据。如果他们已经进行了自己的测试,你将需要获得这些数据。
● 临床数据。例如,可能有上游设备或含有类似材料的设备已经被批准上市。
● 分析数据。这可能被用来确认低风险。
Q3、我需要为我的医疗设备进行哪些生物相容性测试?
你需要做的确切测试根据你拥有的数据和信息而有所不同。证明生物相容性有三个步骤。
1.制定一个生物评估计划(BEP)。这将审查你的设备及其材料,识别潜在的风险,并建议可能的评估或测试来解决这些风险。
2.设备评估和测试。这涉及到使用你的BEP中确定的测试。通常,这些将是体内或体外生物试验、化学试验和毒理学风险评估的组合,是基于科学文献的书面评估。
3.制作一份生物评估报告(BER)。这是对所有测试和评估结果的总结。这将与测试结果一起提交给FDA。
Q4、哪些监管标准和FDA指导文件适用于生物相容性?
ISO 10993是一套指导生物相容性的国际文件。美国食品和药物管理局赞同使用ISO 10993,并为美国的医疗设备开发商准备了自己的关于使用该标准的指导文件。