发布人:管理员 发布时间:2022-10-29
摘要
广泛研究了在 MRI 系统中的医疗器械射频致热问题。采用全波电磁仿真和热仿真工具,研究了器械长度与器械[敏感词]周围的[敏感词]温升的相关性。测试结果显示,“最坏情况”的温升测量结果与仿真数据一致。该工作提出了一种高效、准确的方法,用来评估多种不同尺寸的医疗器械在磁共振环境下的射频致热情况。
关键词
磁共振成像(MRI);电磁仿真 ;RF 致热 ;有源植入式医疗器械(AIMD);无源医疗器械
作者:休斯敦大学 陈戟 郑剑锋 王庆岩 国然 宫兆涛
1 概述
1.1 磁共振环境中医疗器械的安全性在过去的 20 年中,随着植入式医疗器械使用的增加以及磁共振成像(MRI)的快速普及,人们对 MRI 系统中医疗器械的兼容性和安全性越来越关注。MRI 系统产生的电磁场与植入患者体内的医疗器械(包括有源和无源植入医疗器械)之间会产生相互作用,可能会在植入器械上产生磁感应位移力和扭矩、射频致热、图像伪影以及一些电磁兼容性问题[1-2] 。尽管大多数植入器械是使用非磁性材料制造的,这些材料可以在安全级别上有效地控制位移力和扭矩,但器械附近的射频致热已成为主要的安全问题。因此,根据美国食品药品管理局(FDA)的建议,为确保患者安全,植入物和器械都需要 MRI 安全性定标。MRI 安全性定标的程序可以参考美国国际材料试验学会(ASTM)提出的测试方法[3] 。
关于 MRI 相关的射频致热问题,ASTM 规定了相应的测试程序,包括将医疗器械置于“最坏情况”位置的凝胶溶液中,并在器械的多个位置施加较高的 MRI 射频能量,导致了较高特定吸收率(SAR) [3] 。鉴于临床要求 , 许多植入物,尤其是整形外科植入物,可能会有复杂的形状以及各种可能的尺寸(例如,整形外科植入物可能具有不同的长度,具体取决于患者所需的大小),因此评估特定类型植入物的 MRI 相关射频致热有一定难度。还要注意的是,要确定最坏情况下的射频致热,需要大量的实验工作来测试植入物的所有可能尺寸和组合,找出植入物表面的特定位置上[敏感词]的热量。将植入物放入 ASTM 体模,并且在植入物周围放置多个温度探针,以确定最坏情况下的发热位置。但是即使这样做,也不能保证找到[敏感词]的发热位置。因此,要正确研究所有这些参数的组合实验,所需要的时间和精力可能令人望而却步。对于植入式神经脉冲发生器(AIMD),诸如心脏起搏器(IPG),由于不同患者的植入式配置差异,测量温升情况甚至更加困难[4-5] 。起搏器在人的胸部区域可能具有不同的植入位置 ;引线的静脉通路、路径、绕线方式也不同。另外,人体组织的介电常数和电导率因患者而异 ;不同制造商的 MRI 线圈也具有不同的尺寸。所有这些变化都会导致数千个组合的庞大数据集,试验测量不足以覆盖所有这些组合。但是,采用所有有代表性的临床植入导线路径以及其他变量的数值模拟研究对于 MRI 安全标记评估可能更可行。某些医疗器械(例如外固定系统)也需要 MRI 安全评估,但是在 MRI 安全的标准文件中甚至没有提及。
1.2 射频感应加热的数值模拟
随着电磁场的数值计算和仿真技术的发展,现在可以对 MRI 环境中的植入物加热进行严格的仿真,再也不用在 ASTM 加热体模内,测量不同尺寸和配置的植入物表面不同位置的温度,利用电磁数值计算和仿真技术就可以确定每种尺寸和配置的植入物的[敏感词]发热点 /位置。数值计算和仿真能得到整个植入物表面的发热分布。另外,还可以获得在不同入射电场条件下的植入物表面发热分布。通过数值计算和仿真研究,可以确定整个器件系列中发热的最坏情况。然后,根据 ASTM 描述的技术要求,只需对最坏情况的植入物表面上的发热数据进行实验测量。因此,通过数值计算和实验方法的结合,能够快速、[敏感词]、高效地判断整个植入物系列中发
热的最坏情况。
这种数值计算方法通常从电磁仿真开始,以确定 SAR 分布和体模中植入物附近的温度分布。其中,ASTM的体模将同时用于实验和数值计算的研究。而且,大多数仿真工具都可以直接导入植入物的 CAD(计算机辅助设计)文件,从而大大简化了建模过程。通过使用植入物的原始 CAD 数据,可以在仿真工具中准确地描述器械,最终确保获得正确的加热分布。在获得仿真结果之后,需要进行实验测量,两者校对以确保电磁场和热仿真的准确性。
2 无源器械的 MRI 射频效应
骨科器械是用于替换或提供骨骼固定或关节替换的医疗器械。简而言之,骨科植入物是用来替换受损或有问题的关节的。大多数骨科植入物和材料不会对接受MR 检查的患者造成问题。但是,由于植入物的长度或导电环的形成,MR 检查对于某些骨科植入物可能是危险的[6-10] 。在 ASTM F2182 标准中,测试方法适用于完全植入体内的医疗器械。但还有另一种植入情况,即器械不完全位于人体内,例如,用于使骨折的骨头稳定并对齐的外部固定装置,该器械从皮肤外部连接到螺钉上,并且可以从外部进行调节以确保骨头在愈合过程中保持在[敏感词]位置,外部固定装置的主要部分在人体之外 [11-14] 。同样,透皮针头,导管(例如 RF 消融探头,微波消融探头)都是用于从体外[敏感词]的器械[15-17] 。这些器械可能会由于人体外部较高的电场强度而导致较高的射频致热。本章将讨论无源医疗器械的射频致热,[敏感词]部分,通过数值模拟和实验,研究用于脊髓植入装置的射频致热 ;第二部分,研究扩展到外部固定器械的射频致热。
基于 MRI 的电磁数值仿真技术,针对 1.5T/64MHz和3T/128MHz的发送射频线圈环境进行电磁数值模拟。在所有电磁数值模拟中,将结果归一化为1W输入功率。在 FDA 磁共振设备安全性指南中已有定义[18-19] ,可以轻松将结果标准转化为 2W/kg 或 4W/kg。
2.1 数值计算仿真研究
ASTM 体模内的归一化 SAR 分布如图 1 所示。为消除潜在的数值误差,除了非平均 SAR(Peak SAR)分布外,还显示了 1g 的平均 SAR(1g-averaged SAR)
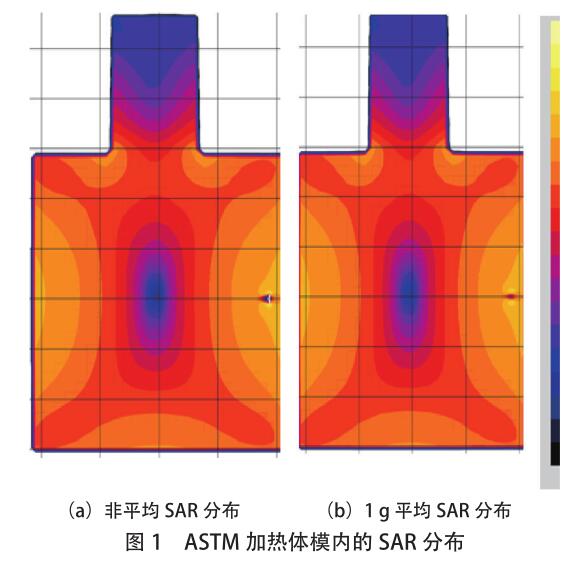
分布。通常,这两个 SAR 分布的全局视图具有相似的模式。图 2 中显示了植入物附近 SAR 分布的放大视图。图中的绿色小方块表示[敏感词] SAR 位置,非平均 SAR 分布和 1g 平均 SAR 分布可以不同,尽管两者都表明[敏感词]SAR 值(对应于[敏感词]热量)出现在器械的末端。但是,当骨科植入物的长度增加到 6.7cm 时,情况并非一定如此,如图 3 所示,[敏感词]非平均 SAR 位于螺钉的[敏感词],而[敏感词] 1g 平均 SAR 位于植入物的顶部。由于温度上升是一个扩散过程(此处参考),因此[敏感词]温度更可能是位于观测到[敏感词] 1g 平均 SAR 的位置附近。为了清楚地确定[敏感词]加热位置,必须进行热仿真。
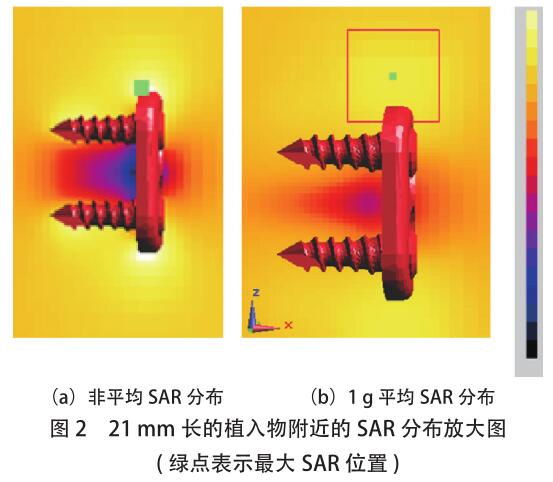
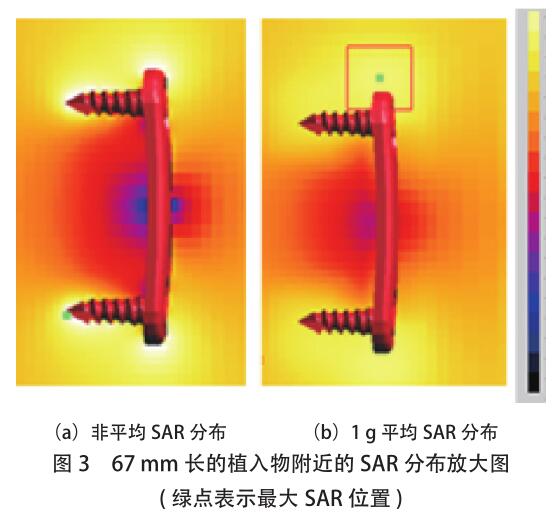
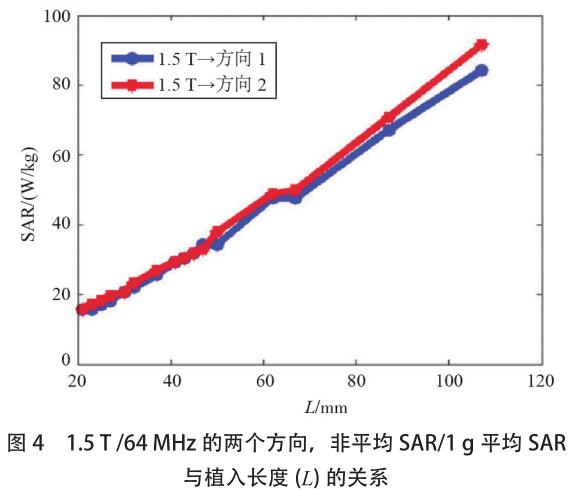
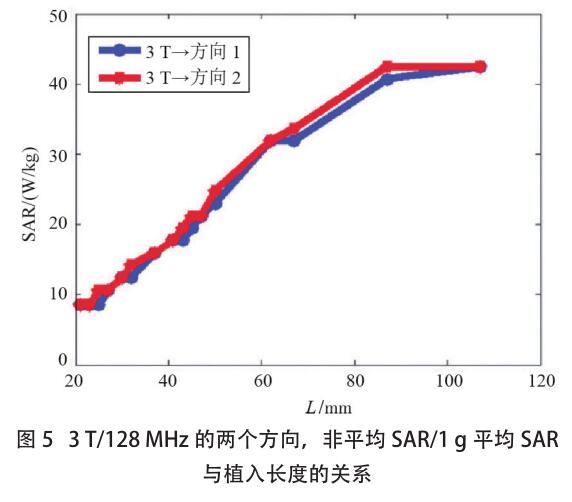
图4和图5分别显示了在1.5T/64MHz和3T/128MHz时非平均 SAR 与植入物长度的关系,两种植入物方向的非平均 SAR 和 1g 平均 SAR 相似,它们都随着植入物长度的增加而增加。
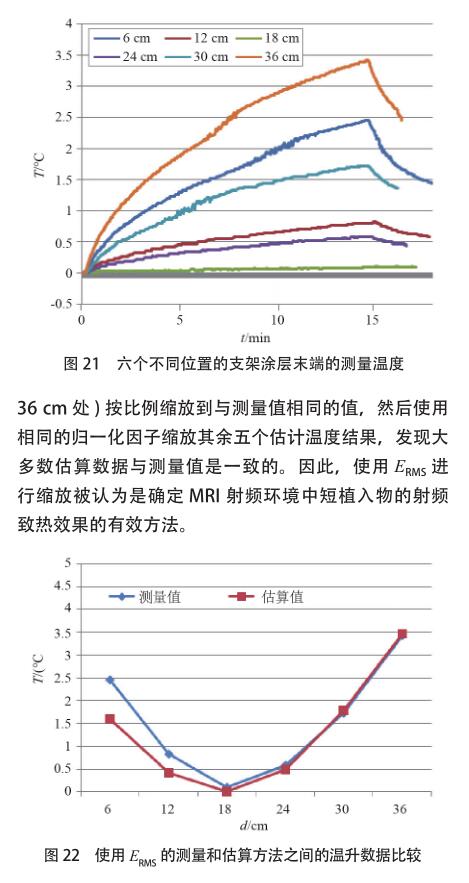
针对这个器械的研究表明,输入相同能量,3T/128MHz 下的[敏感词]区域附近显示出较低的 SAR,也就是说,3T/128MHz 条件下,发热量将更少。图 5 的结果还表明,此器械在 3T/128MHz 时的 SAR 值似乎在植入物长度的 10 cm 附近达到平稳状态,这可以解释为共振波长效应。当植入物大于 10 cm 时,其长度大于胶凝盐内部 3 T/128 MHz 的半波长长度。对于这种情况,[敏感词]加热位置可能会接近植入物的末端。但是,随着长度的增加,植入物的尺寸可以变得与入射电磁场的波长相当。由于共振效应以及沿着植入物的入射场的相位变化,潜在的加热将不再具有单调递增趋势。由于该特定植入物的长度没有超过 107mm,因此未做更多的数值计算。图 4、图 5 情况下的输入功率设定为 1W,若用于将来的温度上升评估,这些结果需要根据实际的 SAR 值进行缩放[9] 。
植入器械附近的 1g 平均 SAR 的[敏感词]值的位置对应着有可能发生[敏感词]的温度升高的位置。为了获得温度升高的实际值,需要进行热的数值仿真。热的数值仿真
可以通过其他的基于生物热方程式的热模拟来实现。为了确定温度随时间的变化,找出植入物上预计会出现[敏感词]温度上升的位置,将温度探针放置在附近。在开始
热仿真之前,所有 SAR 值均应校对。例如,当全身平均 SAR 为 2W/kg 时,要确定植入物附近的 SAR 值,有必要计算体模内的总能量损失,根据体模的总重量进行缩放。
与 1.5 T/64 MHz 电磁仿真一样,可以观察到,当来自射频线圈的输入功率为 1 W 时,ASTM 体模内的总能量损耗为0.735 W。当ASTM体模的重量为44.86 kg时,ASTM 体模的全身平均 SAR 为 0.016 W/kg。对于运行正常模式的 MR 系统,全身平均 SAR 被限制为 2 W/kg。因此,应将比例系数 122(2 W/kg/ 0.016 W/kg)应用于先前的 SAR 值。使用该换算的 SAR 值,然后对 2 W/kg的全身平均 SAR 进行热模拟。执行缩放的另一种方法是使用实际 SAR,这需要使用钛棒测量实际 SAR 值,并使用该值将所有结果标准化。
2.2 测量研究
在精心设计的1.5T/64MHz和3T/128MHz的MR系统下,我们进行了温度测量。根据我们的仿真结果,温度探针放置在预计会出现[敏感词]温升的位置附近,如图 6 所示。
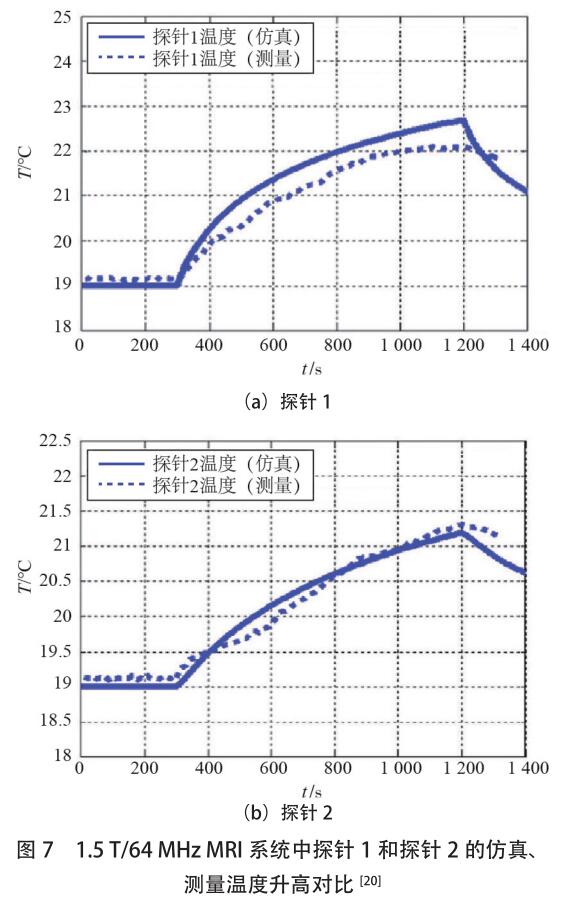
图 7 显示了在 1.5T/64MHz 条件下,15min 内,两个温度探针位置的仿真和测量温度随时间变化的情况。显然,测量和仿真结果吻合。
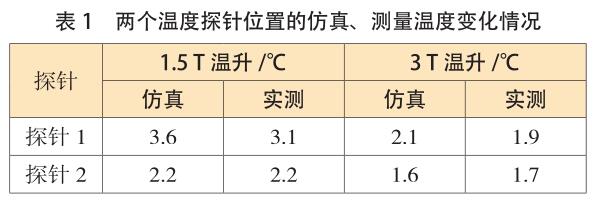
同样地,基于先前获得的结果,对 3T/128MHz 的MRI 系统进行了温升仿真。表 1 显示了两个温度探针位置处,1.5T/64MHz 和 3T/128MHz 条件下,仿真和测量 15min 内获得的温升情况对比,结果显示具有良好的相关性。
2.3 讨论
从电磁和热仿真的结果可以清楚地看到,数值计算和仿真能够良好地评估骨科植入物的[敏感词]温升位置。这种特殊的骨科植入物,[敏感词]温升位置靠近螺钉的[敏感词]和植入物的末端。但是,随着这类骨科植入物的长度增加,尤其是当器械长度与 MR 工作频率的波长接近时,热分布以及[敏感词]加热位置就跟植入物的结构特点密切相关了。
这项研究的结果表明,当骨科植入物的长度小于10cm 时,器械的[敏感词]发热几乎与其长度成线性比例,可以解释为波长效应。在 1.5T 时,电磁入射波长在自由空间中约为 4.5m,在胶凝盐水中约为 0.52m。当该骨科植入物的长度小于 10cm 时,总长度仍小于四分之一波长。因此,预计不会产生大的入射场相位变化或共振效应。但是,对于 3T 的电磁波,胶凝盐水中的波长为 0.26m,10cm 的器件长度已接近半波长谐振尺寸,入射场沿器件将具有较大的相位变化,并且器件将表现出共振效应,因此,[敏感词]加热和器械长度之间将不再简单相关。对于长度超过 10cm 的器械,建议以厘米为增量执行电磁 / 热仿真,以获得不同长度的[敏感词]热量。
这项研究还表明,通过数值计算,可以快速预测哪种器械配置和尺寸将导致[敏感词]的发热以及器械的[敏感词]发热位置。有了这些信息,就可以正确放置温度探针的位置以及确定需要测试的器械的数量,可以显著减少评估MRI 相关加热而进行测试的时间和费用。使用这种测试方法,可以快速预测一个器械系列的最坏情况。
总体而言,电磁和热的仿真能够用来确定长度在21~107mm的骨科植入物的射频致热的最坏情况。对于该特定的植入物产品系列,能够发现,温度升高与植入物的长度有关,并且[敏感词]温升的位置靠近植入物的末端或在螺钉的[敏感词]。我们进行了与 MRI 相关的温升实验并记录温度,以验证数值计算结果,并观察到了良好的相关性。研究结果表明,电磁和热的仿真是确定植入物温升分布及整个器械系列的[敏感词]温升位置的出色工具。如果仅使用一个测量过程,则需要将温度探针放置在整个器械附近,以确定器械附近最坏情况的位置。因此,数值计算是确定最坏情况温升的准确而有效的方法。
由于[敏感词]温升会随植入物尺寸或参数的不同而变化,因此确定[敏感词]温升位置对于正确的测量非常重要。数值仿真提供了一种方法,可以大大减少评估整个器械系列的最坏情况配置和尺寸所需的测量次数。仿真的结果可找到植入物表面的[敏感词]温升位置,在实验过程将温度探针放置在此位置。重要的是,出于验证目的,数值仿真应始终伴随合适的温度测量。
3 MRI 中有源植入医疗器械的兼容性
上一章研究的是无源医疗器械。但还有另一种类型的医疗器械,称为有源植入医疗器械(AIMD),可能会在人体组织中引起更高的射频致热效果。一种广泛使用
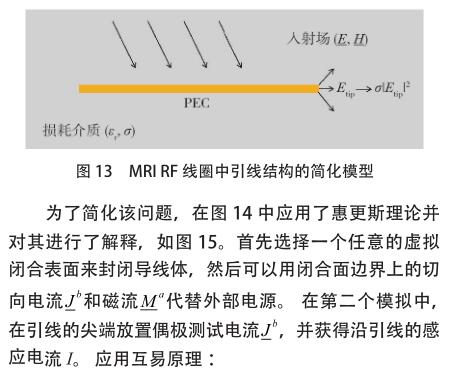
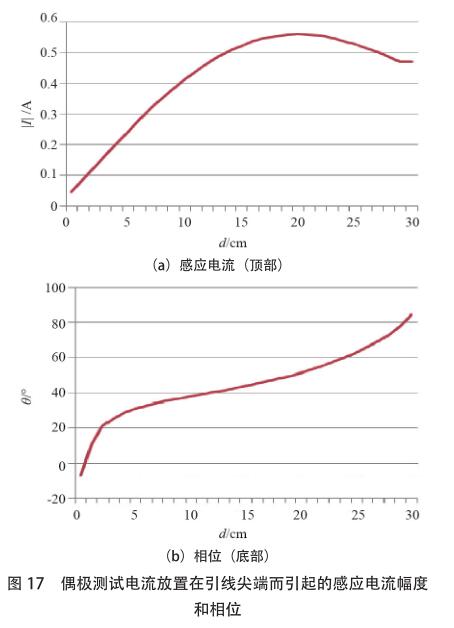
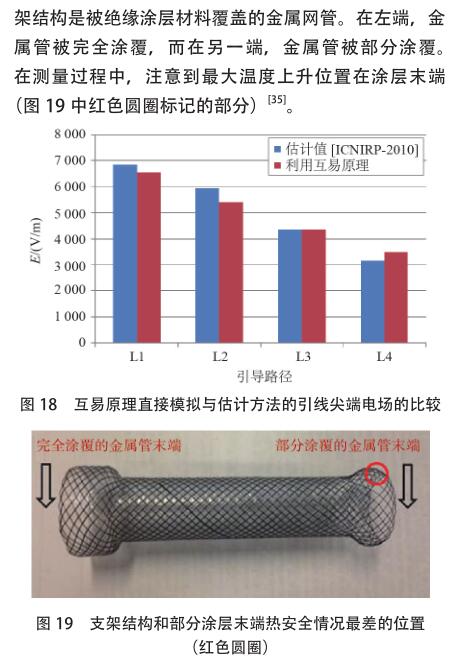
的 AIMD 是心脏起搏器。起搏器由一个大小约为怀表的小型金属装置和一个用于将电脉冲传递至心肌的长导线组成。植入式神经脉冲发生器(IPG)是另一种 AIMD,它是一种电池供电的器械,旨在为大脑提供电刺激。由于 AIMD 植入人体的区域通常位于心肌、大脑或人体的其他重要部位,因此对 AIMD 有广泛的研究。Kainz 等[4]报告说,神经脉冲发生器的前端温度[敏感词]可升高 2.1 ℃,这对患者无害。但是,也有一些研究发现更加危险的射频致热效应。Achenbach 等[21]的研究表明,某些起搏器导线的温度升高了 63.1 ℃ ;Sommer 等[22]的研究表明,根据电极类型的不同,获得的温度升高范围为 0.1~23.5 ℃。Pisa 等[23]发现使用胸腔模型进行 6 分钟 MRI研究时,温度从 0.6 ℃升高到 15 ℃。 Mattei 等[24]通过测量 375 种实验配置,对金属导线上的感应加热进行了研究,并证明了导线在体模中的位置以及导线结构对起搏器导线[敏感词]的温升有重大影响,这些研究中,[敏感词]温度升高约 28 ℃。为了减少由 MRI 线圈内部的射频场引起的射频致热效果,医疗公司已尝试改善其起搏器产品,以使其在 MRI 射频线圈中安全,或至少有条件地安全。根据文献 [25],新的心脏起搏器产品能够通过体外控制,将电极处的 RF 致热从 20 ℃降低到 2 ℃以下。但是,所有满足 MRI 安全或 MRI 条件性安全的 AIMD 的新产品都必须先获得 FDA 的批准,然后才能投放市场。尽管实际测量位于人体的电极[敏感词]的温度升高是不可能实现的事情,但可以选择数值仿真的方法来预测射频致热效果。以下将讨论几种建模方法 :[敏感词]种称为四层级方法,于 2007 年初提出,来源于 ISO TC 150/SC6 有源植入物的委员会和国际电工委员会(IEC)SC 62B MT40磁共振委员会的联合工作组 ;第二种方法是基于互易性原理,该原理不仅能标明如何计算电极[敏感词]的热量,还解释了射频致热的机理。
3.1 四层级方法
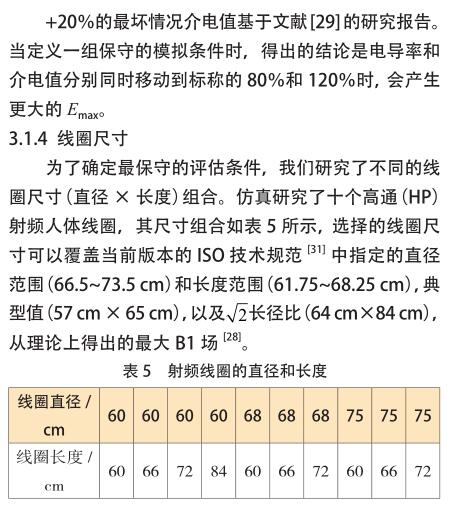
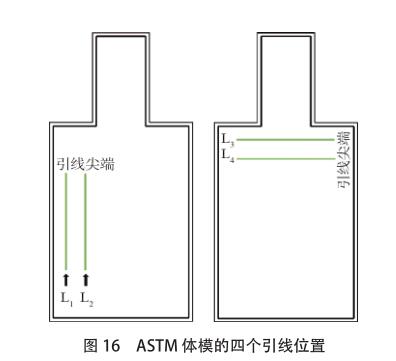
由于在 MRI 射频环境中对 AIMD 进行直接建模的局限性,AIMD 的 ISO/TS 10974 标准于 2007 年发布。根据 AIMD 的 ISO/TS 10974 标准,第 1 层级方法是利用在腔型区域获得的[敏感词]电场 ;第 2 层级方法是指在病人体内植入器械的区域内部获得[敏感词]电场,该区域包括胸腔、静脉和心脏。只要找出植入器械的区域或腔型区域,方法 1 和 2 就能实施。第 3 层级方法需要沿导线路径获得切向电场。显然,第 3 层的[敏感词]步是需要定义足够多的曲线以尽可能覆盖临床引线路径。以下工作是与St Jude Medical 公司合作进行的,选择了14个皮下器械植入位置、6 个静脉通路和 9 个心脏起搏器位置等具有临床代表性的植入路径,来实施第 3 层级的研究。心脏起搏器的皮下植入位置仅限于左侧或右侧的胸腔和乳房下区域。静脉通路仅限于左侧或右侧的腋静脉、锁骨下静脉和颈静脉。心脏内导线[敏感词]植入部位仅限于右心房和右心室内膜。基于所选位点的各种组合,共定义了198 条路径。在这 198 条路径中,共有 54 条路径源自位于乳腺下区域的皮下装置植入位置,这些路径仅适用于成年女性模型,因此,适合肥胖男性、成年男性、女孩、男孩的路径总数减少至 144 条。如果所选择的起搏器导线的长度不够,不能覆盖每个模型的整个路径,则可以进一步减少路径数量。
3.1.1 第 3 层级方法
在 MRI 扫描过程中,由于射频场而导致的小型金属植入物的金属外壳上的感应电流会导致其周围组织发热。ISO / IEC 联合工作组开发了分层方法,利用计算机模拟为有源可植入器械建立最坏情况下的射频致热情况。层级越高,四个层级中的标准就越严格。第2层级中,在临床中植入物相关区域中采用了平均超过 10 g 的区域的[敏感词]电场强度(E max )。模拟的 E max 值用于设置体外测试条件,以估算最差位置的温升。
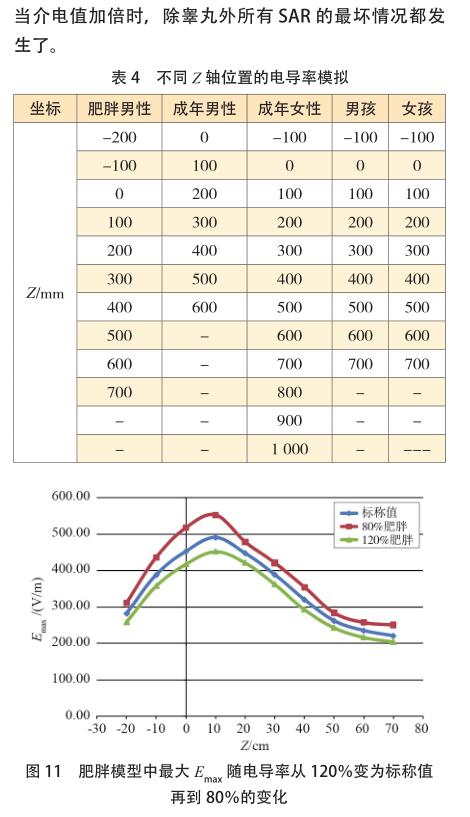
MRI 模拟环境包括人体模型、成像位置、组织特性以及射频线圈类型、直径和长度。五个数字人体模型分别是肥胖男性(Fats),成年男性(Duke),成年女性(Ella),女孩(Billie)和男孩(Thelonius) [26-27] ,其参数如表 2所示。以下将依据图 8 所示的流程表进行全面的模拟研究。
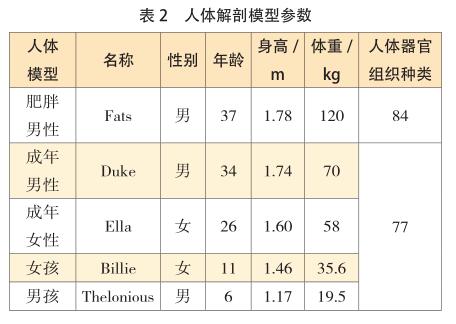
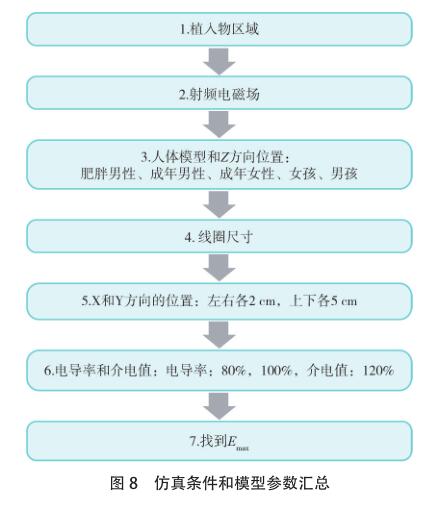
3.1.2 SEMCAD X 数字人体模型
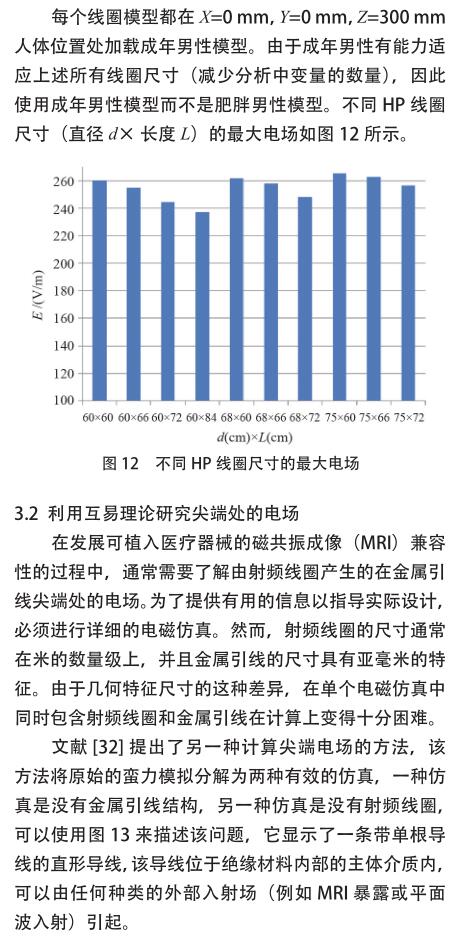
当人体处在 MRI 射频线圈内时,受电磁场能量影响,人体内会产生相应的电场,SEMCAD X 软件包用于这项模拟工作。 SEMCAD X 软件使用有限差分时域(FDTD)方法来迭代计算电场和磁场。这些电场以平均10 g 或 8 g 的量在植入区域内提取,电场的均方根均按比例缩放为 4 W/kg 或 2 W/kg。SEMCAD X 软件创建了16 个梯级极坐标的高通和低通 RF 体线圈的模型。对于高通 RF 体线圈,理想的信号源(图 9 中的红色圆锥体)[敏感词]到每个梯级之间的中间位置 ;第 n 个源的幅度设置为 1 V,第 n' 个源的幅度设置为 -1 V ;相邻信号源之间的相位延迟设置为 2πn/16。对于低通 RF 体线圈,理想信号源沿腿的方向[敏感词]一半位置 ;每个源的幅度设置为 1 V,相邻源之间的相位延迟设置为 2πn/16。以这种方式对源进行建模会迫使电流达到理想的圆极化 RF体线圈的电流[28] 。与包含电容器的模型相比,使用这种RF 体线圈模型可以减少仿真时间,并且不需要进行调谐。
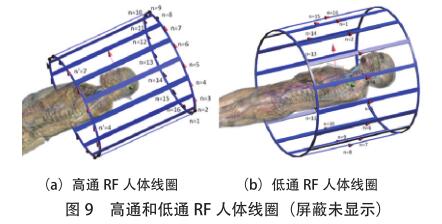
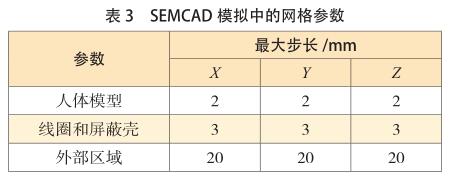
一旦在仿真域中的电场分布收敛,仿真就会停止(这通常需要 20~30 个 RF 信号周期的仿真时间)。模拟边界被单轴完全匹配层吸收边界条件(UPML ABC)包围,因此,冲击波不会反射回计算域。表 3 显示了所使用的网格参数,这些参数在SEMCAD仿真中创建了约1.6亿个像元。










参考文献
[1] F. G. Shellock. Magnetic resonance safety update 2002:Implants and devices[J]. Journal of Magnetic ResonanceImaging, 2002, 16(5): 485-496.
[2] M. N. Hood. Reference Manual for Magnetic Resonance Safety,Implants, and Devices[J]. Journal of Radiology Nursing, 2016,35(3): 252-253.
[3] Z. Lv and D. Chen. Overview of recent work on self-healing in cementitious materials[J]. Materiales de Construccion,
2014(64): 316.
[4] W. Kainz, G. Neubauer, R. Überbacher, et al..Temperature measurement on neurological pulse generators during MR scans[J]. BioMedical Engineering, 2002, 1(1): 2.
[5] H. S. Ho. Safety of metallic implants in magnetic resonance imaging[J]. Journal of Magnetic Resonance Imaging, 2001,14(4): 472-477..
[6] R. Kumar, R. A. Lerski, S. Gandy, et al..Safety of orthopedic implants in magnetic resonance imaging: An experimental verification[J]. Journal of Orthopaedic Research, 2006, 24(9):1799-1802.
[7] J. Zheng, D. Li, J. Chen, et al. Numerical study of SAR for multi-component orthopaedic hip replacement system during MRI[C]//Proceedings of IEEE International Symposium on Electromagnetic Compatibility, 2016. Ottawa, Canada: IEEE:
116-120.
[8] X. Ji, J. Zheng, R. Yang, et al. Evaluations of the MRI RF-Induced Heating for Helical Stents under a 1.5 T MRI System[J]. IEEE Transactions on Electromagnetic Compatibility, 2019, 61(1): 57-64.
[9] Y. Liu, J. Chen, F. Shellock,et al. Computational and experimental studies of orthopedic implants heating under MRI RF coils[C]// IEEE MTT-S International Microwave Symposium Digest, 2012. Montreal, QC, Canada: IEEE, 2012.
[10] R. Guo, J. Zheng, and J. Chen. MRI RF-Induced Heating in Heterogeneous Human Body with Implantable Medical Device[EB/OL].(2018-03-14)[2020-1-16]. https: //www.intechopen.com/books/high-resolution-neuroimaging-basic-physical-principles-and-clinical-applications/.
[11] R. Yang, J. F. Zheng, W. Kainz,et al. Numerical Investigations of MRI RF-Induced Heating for External Fixation Device in TEM and Birdcage Body Coils at 3 T[J]. IEEE Transactions on Electromagnetic Compatibility, 2018, 60(3): 598-604.
[12] Y. Liu, J. Shen, W. Kainz, et al. Numerical investigations of MRI RF field induced heating for external fixation devices[J].BioMedical Engineering Online, 2013, 12(1): 12.
[13] Y. Liu, W. Kainz, S. Qian, et al. Effect of insulating layer material on RF-induced heating for external fixation system in
1.5 T MRI system[J]. Electromagnetic Biology and Medicine,2014, 33 (3): 223-227.
[14] R. Yang, J. Zheng, J. Chen, et al. Comparison study of RF-induced heating in leg phantom with circular external fixator for TEM and birdcage coils at 3 T[C]// IEEE International Symposium on Electromagnetic Compatibility. Washington
D.C., US: IEEE, 2017.
[15] E. F. Stehlin, D. McCormick, S. C. Malpas, et al.. MRI interactions of a fully implantable pressure monitoring device[J]. Journal of Magnetic Resonance Imaging, 2015, 42(5): 1441-1449.
[16] M. K. Konings, L. W. Bartels, H. F. M. Smits, et al. Heating around intravascular guidewires by resonating RF waves[J].Journal of Magnetic Resonance Imaging, 2000, 12(1): 79-85 .
[17] F. Settecase, S. W.Hetts, A.J.Martin, et al. RF Heating of MRI-Assisted Catheter Steering Coils for Interventional MRI[J]. Academic Radiology, 2011, 18(3): 277-285.
[18] Skopec. M. A Primer on Medical Device Interactions with Magnetic Resonance Imaging Systems[N]. FDA government daily journal, 1997-02-04(62).
[19] F. G. Shellock, T. O. Woods, and J. V. Crues. MR labeling information for implants and devices: Explanation of terminology[J]. Radiology, 2009, 253(1): 26-30.
[20] Liu, Yan, Ji Chen, Frank G. Shellock,et al. Computational and experimental studies of an orthopedic implant: MRI-related heating at 1.5-T/64-MHz and 3-T/128-MHz[J]. Journal of Magnetic Resonance Imaging , 2013, 37(2): 491-497.
[21] S. Achenbach, W. Moshage, B. Diem, et al. Effects of magnetic resonance imaging on cardiac pacemakers and electrodes[J].American Heart Journal, 1997, 134(3): 467-473.
[22] T. Sommer, Claas P. Naehle , Alexander Yang, et al. Strategy for safe performance of extrathoracic magnetic resonance imaging at 1.5 tesla in the presence of cardiac pacemakers in non-pacemaker-dependent patients: A prospective study with 115 examinations[J]. Circulation, 2006, 114(12): 1285-1292 .
[23] S. Pisa, G. Calcagnini, M. Cavagnaro, et al.. A study of the interaction between implanted pacemakers and the radio-frequency field produced by magnetic resonance imaging apparatus[J]. IEEE Transactions on Electromagnetic Compatibility, 2008, 50(1): 35-42.
[24] E. Mattei ,M. Triventi, G. Calcagnini, et al. Complexity of MRI induced heating on metallic leads: Experimental measurements of 374 configurations[J]. BioMedical Engineering Online,2008(7): 11 .
[25] R. W. Gray, W. T. Bibens, and F. G. Shellock. Simple design changes to wires to substantially reduce MRI-induced heating at 1.5 T: Implications for implanted leads[J]. Magnetic Resonance Imaging, 2005, 23(8): 887-891 .
[26] Christ A, Kainz W, Hahn E. The Virtual Family - Development of surface-based anatomical models of two adults and two children for dosimetric simulations[J]. Physics in Medicine and Biology, 2010, 55(2): 23-38.
[27] Gosselin M C, Neufeld E, Moser H, et al. Development of a new generation of high-resolution anatomical models for medical device evaluation: the Virtual Population 3.0[J].Physics in Medicine & Biology, 2014, 59(18): 5287-5303.
[28] J. Chen, Z. Feng, and J. M. Jin. Numerical simulation of SAR and Si-field inhomogeneity of shielded rf coils loaded with the human head[J]. IEEE Transactions on Biomedical Engineering,1998, 45(5): 642-649.
[29] E. Neufeld, S. Kühn, G. Szekely, et al.. Measurement,simulation and uncertainty assessment of implant heating during MRI[J]. Physics in Medicine and Biology, 2009, 54(13):4151-4169.
[30] Mattei E, Triventi M, Calcagnini G, et al.. Temperature and SAR measurement errors in the evaluation of metallic linear structures heating during MRI using fluoroptic® probes[J].Physics in Medicine and Biology, 2007, 52(6): 1633-1646 .
[31] ISO/TS 10974: Assessment of the safety of magnetic resonance imaging for patients with an active implantable medical device[S]. Geneva, Switzerland: International Organization for Standardization, 2018.
[32] S. Feng, R. Qiang, W. Kainz,et al. A technique to evaluate MRI-induced electric fields at the ends of practical implanted lead[J]. IEEE Transactions on Microwave Theory andTechniques, 2015, 63(1): 305-313 .
[33] ProtectionNIR . Guidelines for limiting exposure to time-varying electric and magnetic fields (1 Hz to 100 kHz)[J].Health Physics, 2010, 99(6): 818-836.
[34] G. Ziegelberger. ICNIRP statement on the 'guidelines for limiting exposure to time-varying electric, magnetic, and electromagnetic fields (UP to 300 GHz)[J]. Health Physics,2009, 97(3): 257-258.
[35] Li Dawei, Zheng Jianfeng, Liu Yan, et al. An efficient approach to estimate MRI RF field induced in vivo heating for small medical implants[J]. IEEE Transactions on Electromagnetic Compatibility.2015, 57(4): 643-650.