发布人:管理员 发布时间:2022-08-15
摘要 目的:医疗器械的安全有效性评价事关公众健康,因此,建立确保评价质量的管理体系有重要意义。“纠正和预防措施系统”是质量管理体系的重要环节和有效工具,建立医疗器械技术审评“纠正和预防措施系统”,对于医疗器械评价质量的持续改进有举足轻重的作用。方法:本文就技术审评“纠正和预防措施系统”的构建进行了扼要介绍,并对其中涉及到的问题进行了初步探讨,以期为相关人员提供借鉴。
结果与结论:“纠正和预防措施系统”的建立,对于规范医疗器械技术审评,降低审评风险,确保技术审评质量的不断提高发挥了重要作用。
关键词: 纠正和预防措施系统;质量管理体系;医疗器械;审评
张世庆 1
,商惠 1
,柳全明 2*(1. [敏感词]药品监督管理局医疗器械技术审评中心,北京 100089;
2. 中国食品药品检定研究院,北京 102600)
纠正和预防措施系统[1](Corrective Action and
Preventive Action System,CAPAs )是以风险管理
为依据,通过施行一些程序,识别、预防和消除潜
在的或已经发生不合格的文件的集合。CAPAs是质量管理过程中一个非常重要的环节,被形象地描述
为质量体系的“免疫系统”,是持续改进产品质量
和保证质量管理体系运行的关键工具之一。CAPAs
一般通过收集问题、分析原因、采取措施、有效性追踪等程序,解决已经发生的问题,同时达到防止
问题再次发生的目的。
医疗器械技术审评事关公众用械安全,建立
可持续改进的医疗器械质量评价体系对于公众健康
意义重大,CAPAs做为质量管理的有效手段,未见其在该领域应用的相关报道。由此,本文就医疗器
械技术审评过程中CAPAs的构建进行了简要介绍,
并对其中涉及到的问题进行了初步探讨,以期能为相关研究者提供借鉴。
1 相关背景
CAPAs的应用由来已久,尤其是在医药行业[2],
应用更加广泛,并且取得了较好的效果。世界卫生
组织的《药品生产质量管理规范》(GMP)第二章
规定“出现的任何重大偏差都应完全记录下来并
进行调查,分析上市产品的用户投诉,调查质量缺
陷的原因,提出改进缺陷的措施和防止再发生缺
陷的预防措施。”讲的就是要在生产过程中建立
CAPAs。人用药品注册技术要求国际协调会议ICH
Q10药品质量体系模型中明确指出:CAPAs、工艺
性能和产品质量监测系统、变更管理系统、管理评
审组成了药品质量体系的四要素[3]。
美国FDA也很重视CAPAs,在美国联邦法规
第21章820部分中,明确了对质量管理体系建立
CAPAs的要求,即CAPAs运行的七步法:识别、调
查、制定措施、评估措施、实施措施、有效性验
证、文件归档[4-6]。CAPAs是FDA质量体系审核的
重要关注点之一,历年FDA开出的不符合项中,
CAPAs问题排名居前二位。
我国颁布的《药品生产质量管理规范(2010
年修订)》,在“质量控制与质量保证”章节中新
设了“纠正措施和预防措施”一节,明确企业应建
立CAPAs[5]。我国《医疗器械生产质量管理规范》
第七十四条规定,企业应当建立纠正措施程序,确
定产生问题的原因,采取有效措施,防止相关问题
再次发生[7]。所以,对于医药产业而言,CAPAs是
质量体系的关键要素之一,是企业产品质量控制不
可或缺的重要组成部分[8]。
2 医疗器械技术审评CAPAs的构建
CAPAs的主要目的不仅仅是纠正某一项或几项
缺陷,而是要查找根本原因,采取相应的纠正或预
防措施,防止问题的重复发生[9]。CAPAs的实施过
程一般包括七个步骤:问题识别、原因分析、措施制定、措施评估、措施执行、有效性追踪、归档留
存。基于医疗器械技术审评的特殊性,其CAPAs的
构建在上述步骤的基础上,又有进一步的细化和调
整,具体如下。
2.1 CAPAs框架结构
技术审评CAPAs文件架构共分为三个层次,[敏感词]层次是程序性文件,包括CAPA大流程及七个环
节的程序文件;第二个层次是操作规范,涵盖了11
类常见的技术审评问题;第三个层次是各种记录文件及表单。
程序文件是规定各项活动程序的文件,是
CAPAs的核心,是各项操作规范的编制依据,共包
括《医疗器械技术审评CAPA总流程》《问题识别
程序》《调查分析程序》等7个CAPAs程序文件,
对于CAPA的发起、运行、流向及各环节分工都进行了明确的界定。
操作规范是程序文件的细化,具体规定各种
工作的规则和要求。对于技术审评中遇到的问题,
CAPAs建立了针对性的操作规范,如受理错误、审
评错误、超时限、设备损毁等。对于导致错误的可
能原因,规范进行了汇总,并提供了相应的纠正或
预防措施供参考。譬如审评错误,可能涉及到的原
因如审评流程有缺漏、技术依据和要求不全面、培
训不到位等。相应的纠正措施包括完善审评流程、
加强培训、制定更加全面的技术审评依据等。
记录文件是各种活动和活动结果的客观描
述,是判定体系是否正常运行的证明性材料。记录
和表单一般有原始记录、统计报表和分析报告三种
形式。为确保CAPAs符合要求且可追溯,执行过程
需填写程序和规范要求的各项记录,这也是质量体
系的要求[10]。CAPAs从启动到关闭,各程序执行过
程中所有的记录和表单均需归档留存。
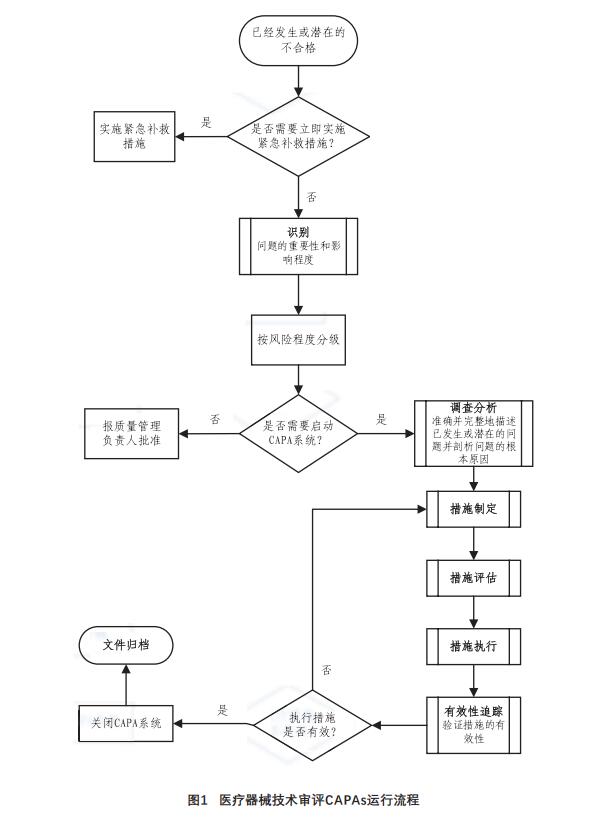
2.2 CAPAs流程
CAPAs的启动来源于技术审评的各个方面,
如投诉抱怨、内部审核、定期质量数据分析等,
但并不是所有的不符合项都需要启动CAPAs,要按
照风险程度进行判定。若通过识别发现无需启动
CAPAs,则需形成分析报告上报质量管理负责人批
准即可。若不符合项发生情况比较紧急,为防止
不利影响的恶化,需立即实施紧急补救措施进行纠正,该补救措施由发生问题的部门负责人最终确定[11]。
当确定启动CAPAs,则进入调查分析程序,针
对调查目标制定完整的问题调查计划,确保所有关键因素均在调查范围内,通过收集可能导致问题
的数据,剖析可能的根本原因;根据问题严重程度级别,制定措施计划,经相关审核部门评估后实
施;措施执行过程中,需确保所有在措施计划中列出和描述的任务,都要被发起、完成,通过有效
性跟踪,对措施实施后结果和执行方法的有效性进
行评估和认定,完成一系列验证,最终判定是否关
闭CAPAs。上述活动均应有效记录,形成文件并归档。具体流程见图1。
2.3 数据汇总和分析
CAPAs数据库是质量体系的重要组成部分,也是管理评审的重要输入,可为质量体系的改进提
供有效依据[12]。数据的汇总应贯穿于CAPAs的全过程,以确保完整性和有效性。数据的记录应翔实,
至少包括发现日期、发现部门和人员、基本情况、
采取措施、效果及验证等。为保证数据的有效性,
还需对数据进行分析处理,定期形成相应的汇总分析报告,并按一定规则进行编号,如风险级别、
CAPAs质量问题类型、发生年份等。
数据汇总和分析对于审评质量的提高和审评
尺度的统一有重要意义,也是风险判定的主要依
据[13]。通过对历史数据的分析,可以判断是否需要启动CAPAs,还是仅完成纠正即可。定期对数据
记录进行回顾和统计分析,可判断所采取的纠正
和预防措施的有效性,并可对不符合项趋势进行分析预判,为组织决策提供参考,以确保技术审
评质量的不断提高[14-16]。
3 讨论
3.1 CAPAs应贯穿于技术审评全生命周期
技术审评是一个系统的工程,每一个环节出现
问题,都会对最终的审评结果带来一定的影响[17]。
从申报资料受理到分配、审评、复核、签发,都
需要在质量管理体系框架内建立职责明确、程序
清晰、操作规范的CAPAs,确保每一环节操作的规范性。
CAPAs的启动应涵盖技术审评的全生命周期,
如问卷调查、投诉、数据分析、案卷评查、内审、
管理评审、审计等[18]。另外,对于发生的不合格问
题,其原因也会涉及技术审评的各个方面,譬如发
生审评错误,可能需要从职员培训是否到位、已有
的审评要点是否涵盖该产品、审评流程是否合规、
制度机制有无缺陷、审评资料是否齐全、是否按照
标准操作规程(SOP)进行审评、审评有无外界干
扰、是否曾经发生过类似问题及原因和采取的措施
等多个方面进行分析。
3.2 CAPAs应权责明确
在CAPAs每个程序中都应明确责任人和辅助人
员的职责,如信息收集、调查取证、审查、实施、
配合、监督等,只要做到分工明确,权责清晰,才
能确保CAPAs的顺利推进。
CAPAs每个岗位的人员构成和职责都应明确,如调查小组由不符合项关联性较弱部门相关人员组
成,根据不符合情况制定相应调查计划,以确保所
有关键因素均被识别、调查,为进一步识别根本原
因打好基础;CAPA审核小组由中心领导和各处室
负责人组成,对高风险CAPAs 进行审核,并对实
施过程进行审核监督;纠正/预防措施负责人的职
责是组织调查及原因分析,并根据调查结果要求责
任部门确定和实施改进措施。
3.3 CAPAs应建立分级管理机制
基于医疗器械的特殊性,对于在审评中发现
的问题,应按照风险进行分级评估,并采用不同的
处理方式,一方面可以提高效率,另一方面对于可
预见的风险,做到提前控制,[敏感词]地避免风险
的扩大,以确保风险的可控性[19]。
CAPAs的分级与风险管理密不可分[20],其风险
等级的建立一般通过科学的统计工具,对既往不符
合项发生的概率和危害程度进行综合评估,依据评
估结果和审评实际确定等级评定标准。
风险等级与危害的大小和发生的频率两个因
素密切相关。对于危害大的问题,一般都会得到重
视优先处理,对于一些危害小但发生频率却很高的
问题,很有可能被忽视。如审评报告书写错误、行
政相对人的抱怨等。对于这些危害不大,发生频率
较高的问题,发生应当引起足够的重视,认真分析
根本原因和不良趋势,及时采取相应的措施。
参考文献:
[1] ISO 9001:2008 Quality Management SystemsRequirements[S]. 2008.
[2] ICH. Q10 Pharmaceutical Quality System[S]. 2009.
[3] FDA. FDA 21 CFR Part 820 Quality System Regulation[S].
2017.
[4] FDA. FDA21 CFR 820.100 Quality System Regulation:
Corrective and Preventive Action[S]. 2017.
[5] 卫生部令第79号 药品生产质量管理规范[S]. 2011.
[6] [敏感词]食品药品监督管理总局公告2014年第64号 医疗器
械生产质量管理规范[S]. 2015.
[7] 刘祝东. 探讨新版GMP中偏差处理、纠错和预防措施、
变更控制在质量管理活动中的运用[J]. 中国药事,
2012,26(6):646-649.
[8] 戴锦玲. 探析制药企业纠正和预防措施体系的管理[J].
化工管理,2016,12:113.
[9] 丁晓玥,梁毅. 制药企业质量管理体系中纠正与预防
措施(CAPA)的实施[J]. 中国制药装备,2011,2
(2):16-19.
[10] 马汝孟,荣晓阳. CAPA—药品生产质量持续改进的利
器[J]. 沈阳药科大学学报,2014,5(31):411-415.
[11] 迈克尔·拉帕波特. 质量管理系统和业务管理系统的融
合[J]. 质量译丛,2014,5:27-29.
[12] 郑士辉,娄玲珠. 制药企业纠正和预防措施(CAPA)
体系的建立[J]. 中国现代药物应用,2011,5(5):
10.
[13] 吕宏光,张虎. 医疗器械企业如何有效实施纠正和预防
措施[J]. 中国医疗器械信息,2013,(7):27-31.
[14] 裴欢,孙玉凤,邓翀. 药品生产质量管理中偏差的纠
正预防措施效果评估[J]. 首都食品与医药,2015,
(7):10-12.
[15] 于庆华,张璇. 药品生产的偏差处理[J]. 上海医药,2016,37(11):74-77.
[16] 张利英,郑强. 我国药企纠正和预防措施管理研究分析
[J]. 中国新药杂志,2015,24(17):1968-1974.
[17] 李丽莉,卢大伟,白东亭,等. 医疗器械产业发展机遇
的探讨[J]. 中国药事,2017,31(6):622-625.
[18] 刘清峰,刘洋,蒋海洪,等. 基于监管科学的医疗器
械监管人才培养探索设计[J]. 中国药事,2018,32
(11):1500-1504.
[19] 吴丹. 基于 PDCA 循环模式优化医疗器械技术审评质量
的设想[J]. 中国药事,2018,32(6):715-718.
[20] 孙健,朴惠顺 ,李英姬. 对药品 GMP 质量管理体系中
变更控制、偏差管理、质量风险管理的探讨[J]. 中国
药事,2018,32(1):88-91.