李澍,郝烨,王权,任海萍* (中国食品药品检定研究院,北京 102629)
摘要 目的:在同样标准、尺度下进行有源植入医疗器械“MR兼容”性评价,确保有源植入医疗器械 的使用安全和有效。方法:本文依据ISO/TS 10974:2018标准,结合中国食品药品检定研究院的工作, 针对标准中要求的各个试验的试验依据、试验方法、接收准则进行了研究。结果:标准共涉及6项已知 或可预见的风险,分别为温升、振动、力、力矩、非预期的刺激以及器械故障。为了评价这些风险,本文介绍了和6项风险相对应的9个试验项目,以此评价有源植入医疗器械的核磁兼容性。结论:目前国内 针对有源植入医疗器械核磁兼容性的评价刚刚起步,一些检测手段和方法处在借鉴和摸索之中,本文系 统性介绍了评价项目的考虑角度和方法,为国内从事有源植入物核磁兼容性设计及评价者提供参考。 关键词: 有源植入性医疗器械;核磁兼容;ISO/TS 10974:2018 中图分类号:R28 文献标识码:A 文章编号:1002-7777(2019)10-1109-07 doi:10.16153/j.1002-7777.2019.10.005 Study on Safety Evaluation Methods for Magnetic Resonance Imaging of Active Implantable Medical Devices Li Shu, Hao Ye, Wang Quan, Ren Haiping* (National Institutes for Food and Drug Control, Beijing 102629, China) Abstract Objective: To evaluate the "MR compatibility" of active implantable medical devices under the same standards and scales to ensure the safe and effective use of active implantable medical devices. Methods: According to the ISO/TS 10974: 2018 standard and the work of National Institutes for Food and Drug Control, the test basis, test methods and acceptance criteria of each test required by the standard were studied. Results: Six known or predictable risks which were involved in the standard were found out, namely temperature rise, vibration, force, moment, unexpected stimulus and device failure. In order to evaluate these risks, nine experiments corresponding to six risks were introduced in the paper to evaluate the MR compatibility of active implantable medical devices. Conclusion: At present, the evaluation of MR compatibility of active implantable medical devices in China has just started, and some testing methods are still in the process of exploration. This paper systematically introduces the considerations and methods of evaluation in order to provide references for the design and evaluation of MR compatibility of active implantable medical devices in China. Keywords: active implantable medical devices; MR compatibility; ISO/TS 10974:2018
1 背景
近年来,随着生物电子技术的发展,有源植入医疗器械的使用范围越来越广泛,以起搏器及心 律转复除颤器、神经肌肉刺激器、人工耳蜗、左心 室辅助装置为代表的新型有源植入类医疗器械相继 问世,挽救了无数人的生命。然而,由于有源植入 医疗器械内部的电子元器件可能对电磁场较为敏 感,易受强电磁场干扰而导致设备功能异常。而 核磁共振成像(MRI)扫描时可产生3种类型的电 磁场:静态场B0、梯度场G、射频场RF。其中静态 磁场B0引力可造成有源植入设备内的磁敏感金属发 生震动,导致设备故障、位移或者损坏;梯度磁场 可能造成设备工作模式的异常转变和复位[1];射频 磁场可通过经皮电缆及导线导致与人体接触的部位 组织温度升高,造成器官受损甚至组织穿孔[2]。所 以,对于使用有源植入医疗器械的患者来说,核磁 共振检查一直列为禁忌症[3]。然而,MRI是重要的 临床影像学手段,尤其对于神经系统和软组织病变 的评估具有独到的价值[4-5]。与CT/PET相比,它无 放射线损害,无骨性伪影,有高度的软组织分辨能 力,对显示血管的结构、软组织之间相互鉴别,有 其独到之处[6]。所以对于使用有源植入类医疗器械 的患者来说,核磁共振检查应用的限制可能会对疾 病的诊断产生较大的影响[7]。
在这样的需求矛盾下,使用非磁性敏感元 件、并通过特殊设计的机壳和导线实现“MR兼 容”的有源植入医疗器械应运而生。因此,在同样 标准和尺度下进行科学、有效的有源植入医疗器械 “MR兼容”性评价,确保有源植入医疗器械产品 的安全性和有效性,是世界各国的医疗器械生产者 以及监管者的目标[4,8]。在此背景下,国际标准化 组织于2012年首次发布了关于有源植入医疗器械核 磁兼容性的评价方法ISO/TS 10974:2012[9],并不断 讨论、更新评价方法,并于2018年4月发布了ISO/ TS 10974:2018《患者带有有源植入性医疗器械用 核磁共振成像的安全性评定》[10]。
目前,国内针对有源植入医疗器械核磁兼容 性的评价刚刚起步,因此,在产品研发及质量评价 过程中缺乏相应评价和验证平台。本文旨在系统性 介绍ISO/TS 10974:2018标准(以下简称标准)所考 虑的评价角度和方法,为国内从事有源植入医疗器械核磁兼容性设计及评价者提供参考。
2 总体概述
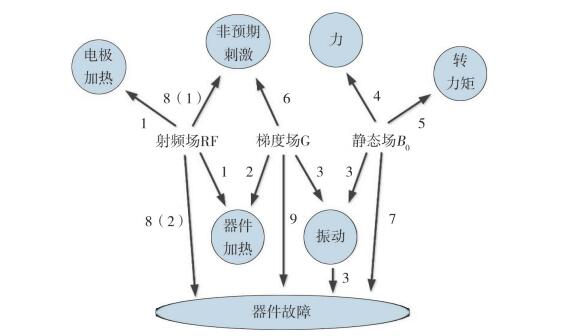
ISO/TS 10974:2018标准共归纳出6项已知或可 预见的风险,分别为温升、振动、力、力矩、非预 期的刺激以及器械故障。为了评价这些风险,本文 介绍了和风险相关的9个试验项目,见图1和表1。 其中,射频场加热试验(编号1)评价由于射频电 场辐射造成的局部比吸收率(SAR)升高以及器件 感应电流增大所导致的温升。梯度场加热试验(编 号2)评价梯度场产生涡流导致的器件温升。梯度 场振动试验(编号3)评价静态场B0和梯度场的联 合作用下器件的运动。力和力矩试验(编号4和5) 评价静态场B0与磁性材料相互作用下器件受力情 况。梯度场感生电势试验(编号6)评价梯度场在 器械外部产生的感应电压所引起的输出脉冲的改 变,但不涉及器械故障。射频场感应整流电压试验 [编号8(1)]评价在感应电压足够高的条件下,远 端电极上产生的非预期电压脉冲对设备的影响。故 障试验[编号7、编号8(2)和编号9]则评价在场的 作用下引发的设备故障所导致的性能下降、功能丧 失、意外反应等。
表1 MRI对有源植入医疗器械产生的潜在风险和相应的评价试验方法
图1 MRI 3个输出场(射频场、梯度场和静态场)及所包含风险的相互关系
3 9个试验项目的评价方法
按照表1顺序,依次介绍每一个潜在风险产生 的原理、试验方案设计及其评价方法。
3.1 评价射频场加热对患者造成伤害(功率沉 积) 射频场在与生物体相互作用的过程中,给予 生物体的电磁能量(宏观上表现为加热作用)称为生物电磁剂量。为了[敏感词]衡量人体电磁辐射剂量, 学术界采用比吸收率(Specific Absorption Rate, SAR)来定量描述生物组织对电磁场能量的吸收。
其中,P为功率沉积,E为感应电场的均方根 值,σ为电导率,ρ为组织密度,c为比热容, t表 示局部温升,υ为功率沉积需要评估的体积,t为时 间, Tbackgnd为在未安装有源植入医疗器械时所测得 的背景温度, Ttotal为安装有源植入式医疗器械时所 测得的系统温度。
需要说明的是,试验要求体外测试环境与目 标组织在电磁学参数上相一致,从而保证体外环境 和体内环境的SAR值是大致相等的。这样实验室测 得的功率沉积也是有源植入医疗器械所产生的体内 功率沉积。测试过程中,需要同时衡量功率沉积的 空间分布和强度。空间分布与有源植入医疗器械的 局部几何特性和周围组织参数有关。强度与有源植 入医疗器械吸收射频能量的能力相关。
3.2 评价梯度感应加热对患者造成伤害
梯度感应加热是由于梯度场BG(t)在有源植入医 疗器械导电外壳或内导体表面(如电池组件表面比吸收率的具体定义为单位质量的生物组织吸收的 电磁功率,单位是W/kg。射频感应加热对患者造 成的伤害与环境温度、射频持续时间以及器械植入 方式有关。局部组织温度升高最终会造成组织损伤 或植入器械疗效降低。 测量射频场加热应首先测量在未安装有源植 入医疗器械条件下的背景比吸收率(温升),然后 测量将器械植入后的系统比吸收率(温升)。评价 指标功率沉积是因植入器械所产生的净比吸收率 (温升),见公式(1)。
和电路板表面)会产生涡流(Eddy Currents),进而造成加热作用。一般来说,测量梯度感应加热温 升时,需要考虑特定核磁共振脉冲序列BG(t)的均方 根值、暴露时间、梯度场法线方向和器械平面形成 的夹角。植入物表面积越大,导电率越高,加热就越大。
评价涡流造成的感应加热需要将有源植入医 疗器械曝露在规定的梯度场BG(t)中,并测量由此产 生的温升。试验环境采用最小热对流、只存在热传 导路径的环境(如凝胶溶液或保温箱)。试验中, 不需要将器械曝露在核磁共振脉冲序列BG(t)的[敏感词] 值中,只要所用磁场产生的温升足够大,其信号与 噪音比至少达到10∶1,则可以按比例缩减暴露骚 扰信号BG(t)并进行测试,在计算温升时按相应比例 还原即可。
3.3 防止梯度感应振动对患者造成伤害
MRI的梯度场会在有源植入医疗器械导电表面产生涡流。这些涡流会形成时变磁矩,时变磁矩与 静态场(B0)相互作用会使导电表面和器械产生振 动。梯度感应振动与典型的有源植入医疗器械振动 (如运输、患者活动)不同。梯度感应振动的力和 力矩都是在器械内部的,并可能会导致患者损伤, 并引起功能下降或治疗水平减弱。
因梯度感应振动导致的有源植入医疗器械故 障的评估方法详见图2。首先根据制造商宣称所能 耐受的[敏感词]磁场强度确定试验用MRI扫描仪的输出,并确定尺度因子(若输出值是临床[敏感词]值的 20%,则尺度因子为5)。在此输出的条件下,测 试有源植入医疗器械的振动响应,由此响应乘以尺度因子,则为实际振动水平。考虑到不同的核磁序 列条件下有源植入医疗器械振动的形式和水平不同,试验中需要记录所有序列的振动状态,并合 并成最严酷的振动波形,通过振动台复现此振动水平,并在振动试验中评估有源植入医疗器械的性能。
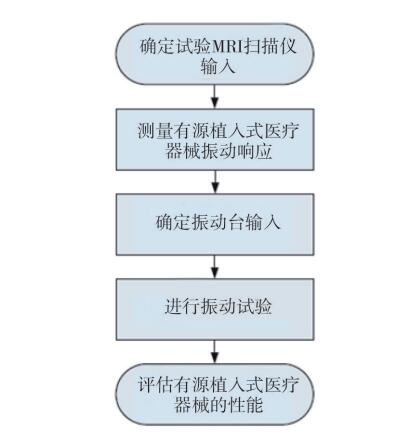
图2 梯度感应振动测试流程图
3.4 防止B0位移力对患者造成伤害
静磁场(B0)产生的位移力可能会导致含有磁 性材料的器械发生非预期移动。有源植入医疗器械 一般包含顺磁性材料、抗磁性材料和铁磁材料。对于顺磁性材料、抗磁性材料或低磁化饱和度的铁磁 材料,[敏感词]位移力点位于静磁场(B0)和磁场的空 间梯度( △ B0)的乘积[敏感词]的点。对于高磁化饱和度的铁磁材料,[敏感词]位移力出现在磁场的空间梯度( △ B0)[敏感词]的位置。此部分内容具体测试方法可 参考YY/T 0987.2《外科植入物磁共振兼容性第2部 分 磁致位移力试验方法》[11]。
3.5 防止B0感应力矩对患者造成伤害
静态磁场(B0)产生的磁感应力矩可能会导致 含有磁性材料的器械发生非预期移动。磁感应力矩 随B0变化,应在静态磁场均匀的位置进行测量(如 核磁共振扫描仪的等中心点,即MRI机架的旋转 中心点)。此部分内容具体测试方法可参考YY/T 0987.5《外科植入物磁共振兼容性第5部分 磁致扭 矩试验方法》中的规定[12]。
3.6 防止梯度场感应电势对患者造成伤害
外部感应电势是由于有源植入医疗器械单个 导线电极之间、多导线电极之间或电极和组织接触 的外壳之间会形成梯度场感应电压。此电压使得有 源植入医疗器械端口和导电外壳之间产生电流。若 有源植入医疗器械阻抗过低,所产生的电流会很 大,则会导致与电极接触的组织受到非预期刺激。 这些刺激可能不会导致器械失效或故障,但可能会使患者受到不同程度的伤害。
梯度场感应电势对患者造成的伤害通过评估 梯度场产生的非预期电荷、电流或治疗输出失真来 衡量。试验适用于含有两个或以上组织接触电极的 有源植入医疗器械。通过将组织等效接口电路连接 到有源植入医疗器械进行测试,分别进行以下3个 试验来评估梯度感应效应:1)测量每个梯度脉冲 下的梯度感应电荷和电流;2)测量有源植入医疗 器械暴露在长梯度脉冲序列中的平均整流电流; 3)评估扫描期间,有源植入医疗器械在输出治疗 运行状态下的梯度脉冲失真。
3.7 防止B0感应故障对患者造成伤害
有源植入医疗器械暴露在MRI的B0场中会影响 其功能,包括器械重置、程序改变、剩磁、电池耗 竭以及[敏感词]性损坏。本试验根据有源植入医疗器械 在MRI 1.5T静态磁场(B0)下的潜在风险类别,通 过分级并定义合适的试验来评估潜在影响。
表2列出了会受到静态磁场影响的有源植入医 疗器械组件。若组件在MRI扫描期间禁止使用,则 不需要进行附加试验。3个级别关注的问题及试验 方法不同。主体思想是根据器械的预期用途来选择 恰当的试验方法,所有器械需要在试验后迅速检测 B0剩磁的潜在影响。
表2 有源植入医疗器械基于静磁场感应故障的分级及试验方法
3.8 保护患者不受射频感应故障及射频整流伤害
有源植入医疗器械暴露在MRI的射频场可能会出现如下问题:未能提供预期治疗功能、编程错误、器械重置、器械[敏感词]损伤以及射频整流引起的 组织刺激等。这些影响可能是短暂或[敏感词]的,而且可能会产生对使用者造成安全隐患。射频感应故障 测试方法将包含辐射暴露测试和注入射频测试, 取决于受测试的有源植入医疗器械系统类型,见表3。
辐射暴露测试:对于没有外部导体或只含电 小长度外部导体(物理尺寸远小于电磁波波长)的 有源植入医疗器械,可采用TEM横电波小室产生所 需要的射频电场,进行测试。由于器械尺寸很小, 因此测试所用的均匀域体积可以很小。
注入射频暴露测试:通过射频注入网络将射频能量注入射频传导路径,若有源植入医疗器械外 壳包含屏蔽,射频注入网络需将屏蔽作为参考地或 参考节点。若有源植入医疗器械含有可能刺激组织 的电极,则射频输入网络应能在注入骚扰的同时监控端口整流电流。
3.9 保护患者不受梯度感应故障伤害
MRI梯度磁场可能对有源植入医疗器械运行或 性能造成负面影响,如导致无法提供预期治疗、内存损坏、短暂或[敏感词]器械编程设置丢失等。这些副作用可能由于梯度磁场穿透器械外壳到达内部电路所产生的感应电压,或是植入器械的导线所产生的外部感应电压。这些影响可能是短暂或[敏感词]的,而且可能会产生对有源植入医疗器械使用者造成不 良影响的安全隐患。梯度感应故障伤害测试同样根 据其预期用途进行测试,如果有源植入医疗器械在 MRI扫描时输出保持激活,则应设置器械工作在典 型治疗模式上,测试中重点观察输出电流、电压和 输出极性。若器械可选择MRI扫描时禁用输出,则测试需重点考察试验后足够短的时间内器械是否能恢复输出,是否存在瞬态故障等。
具体的测试内容包括辐射骚扰测试和注入骚扰 测试,详见表4。所有有源植入医疗器械都需进行辐射测试,根据器械类型,考虑是否进行注入骚扰测试。一般来说,如果器械含有长导线电极,或器械外壳外部安装多个电极,则应进行注入骚扰测试。
表3 射频电磁兼容性测试方法选择
 表4 各种有源植入医疗器械适用的测试方法
表4 各种有源植入医疗器械适用的测试方法
4 结论
本文针对国际标准《在体有源植入性医疗器 械用核磁共振成像安全性评价研究》进行简单的介绍和归纳整理。针对使用有源植入医疗器械并进行核磁共振扫描患者,归纳出6项已知或可预见的风险,分别为温升、振动、力、力矩、非预期的刺激以及器械故障。为了评价这些风险,共设计了9个试验项目。本文针对每个试验的设计依据、试验方 法、接收准则进行了介绍,希望对国内从事有源植入医疗器械核磁兼容性设计及评价者有所帮助。
参考文献:
[1] Catana C,Wu Y,Judenhofer M S,et al. Simultaneous Acquisition of Multislice PET and MR Images:Initial Results with a MR-compatible PET Scanner[J]. Journal of Nuclear Medicine,2006,47:1968-1976.
[2] Zastrow E,Cabot E,Kuster N,et al. Assessment of Local RF-induced Heating of AIMDs During MRExposure[C].Beijing:Ursi General Assembly and Scientific Symposium,2014.
[3] Kuhl C. The Current Status of Breast MR Imaging - Part I. Choice of Technique,Image Interpretation, Diagnostic Accuracy,and Transfer to Clinical Practice[J]. Radiology, 2007,244:356-378.
[4] Hasler G,van der Veen J W,Tumonis T,et al. Reduced Prefrontal Glutamate/Glutamine and Gamma-aminobutyric Acid Levels in Major Depression Determined Using Proton Magnetic Resonance Spectroscopy[J]. Archives of General Psychiatry,2007,64:193-200.
[5] Kaplan F,Kopka J,Haskell D W,et al. Exploring the Temperature-stress Metabolome of Arabidopsis[J]. Plant Physiology,2004,136:4159-4168.
[6] Liu Y,Li D,Min X,et al. Evaluation of Electromagnetic Field Distributions Under 1.5 T MRI Scanning Within Human Models of a Virtual Family[C]. Cambridge,USA: Computing in Cardiology Conference,2014:117-120.
[7] Mouchawar G,Sison S,Chen S,et al. Modeling of MRI-induced Heating in Pacemaker Patients During 1.5TMRI Scans[C]. Nice,France:Computing in Cardiology Conference,2015:769-772.
[8] Barbier T,Aissani S,Weber N,et al. A Novel MRCompatible Sensor to Assess Active Medical Device Safety:Stimulation Monitoring,Rectified Radiofrequency Pulses,and Gradient-induced Voltage Measurements[J]. Magnetic Resonance Materials in Physics Biology and Medicine,2018,31:677-688.
[9] ISO/TS 10974:2012 Assessment of the Safety of Magnetic Resonance Imaging for Patients with an Active Implantable Medical Device[S]. 2012.
[10] ISO/TS 10974:2018 Assessment of the Safety of Magnetic Resonance Imaging for Patients with an Active Implantable Medical Device[S]. 2018.
[11] YY/T 0987.2-2016《外科植入物磁共振兼容性第2部分 磁致位移力试验方法》[S]. 2016.
[12] YY/T 0987.5-2016《外科植入物磁共振兼容性第5部分 磁致扭矩试验方法》[S]. 2016.