医用注射泵检定设备存在的问题及对策研究
2024-01-15
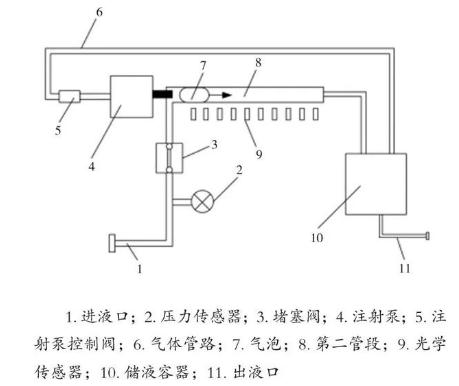
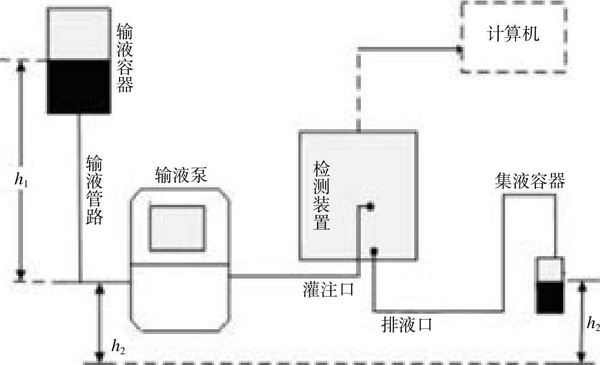
一、注射泵检定装置的工作原理及其特点 本文提供的注射泵检定装置,用于对注射泵的堵塞压力和流速进行测量,大体上包括相互串联的第一管段、第二管段和第三管段,所述第一管段与所述第二管段之间设置有堵塞阀,所述第二管段通过所述第三管段连接至一储液容器。所述第一管段具有一进液口,其上设置有用于测量管路内测试液体压力的压力传感……
ESD静电放电抗扰度试验测试要求是什么,如何有效抑制静电放电的干扰
2024-01-15
依据基础标准GB/T17626.2标准中规定了四个测试等级和1个开放测试等级。具体选择哪个测试等级依据产品所应用的行业领域以及某些特定的场景要求所共同确定。 比较常用的测试等级有: 1、家用、商业用设备通常采用二级的测试要求(接触放电±4kv,空气放电±4kv); 2、对于工业、轨道交通通常采……
浅谈电子内窥镜同品种临床评价要求
2024-01-15
第一部分:电子内窥镜发展史 电子内窥镜发展历程: 硬管式内镜至半曲式内镜,再到光导纤维内镜。 1983年,佳能公司发明CCD技术,电子内窥镜诞生。 2001年以后,胶囊内镜、超声内镜、高清内镜、聚焦内镜等新型技术出现。 电子内窥镜特性: ……
输液泵、注射泵的计量性能
2024-01-12
输液泵、注射泵广泛应用于医疗机构内科、外科、儿科、心血管科、急诊科和手术室,尤其适用于ICU和CCU病房的输液治疗。而使用输液泵、注射泵的患者大多处于病情多变的高危期,输入的常用药物包括血管活性药物、强心药物、抗心律失常药、电解质溶液以及化疗药物等,稍有不慎都将对患者的病情造成不良影响,后果不堪设想。临床上应根据药物和……
医疗器械无菌屏障系统的常见类型都有哪些?
2024-01-12
无菌屏障系统是最终灭菌医疗器械安全性的基本保证。有许多类型的无菌屏障系统用于无菌医疗器械的包装(我们此前讲过一期无菌屏障系统的线上培训课程,感兴趣的可点击右侧观看回放→无菌屏障系统的建立与验证),本期文章我们就跟大家分享一下无菌屏障系统的常见类型: 1、预成形的硬质托盘和盖材 硬质托盘通常用……
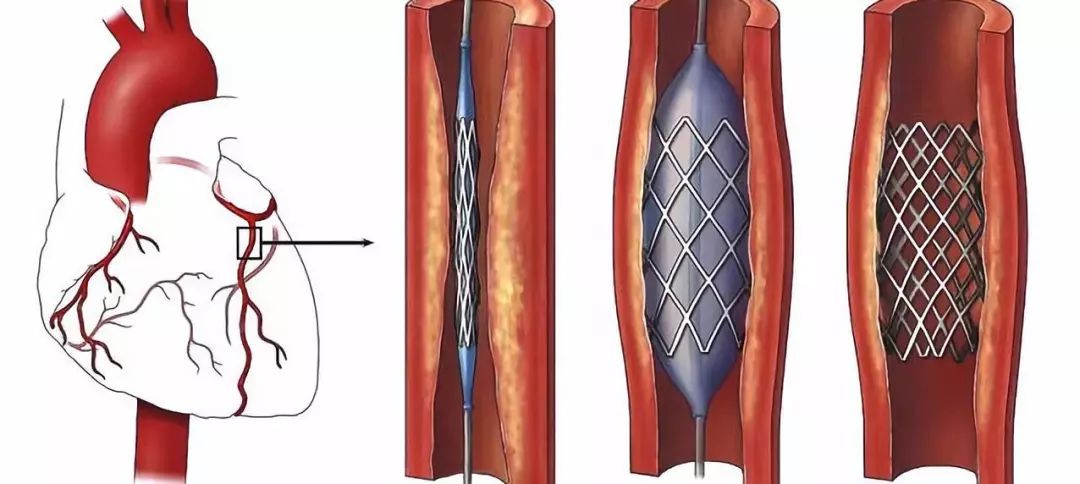
《外周血管支架系统注册审查指导原则》公开征求意见(附全文)
2024-01-12
刚刚,G家药品监督管理局医疗器械技术审评中心发布《外周血管支架系统注册审查指导原则(征求意见稿)》,内容如下: 外周血管支架系统注册审查指导原则 本指导原则旨在指导注册申请人对外周血管支架系统注册申报资料的准备及撰写,同时也为技术审评部门对外周血管支架系统注册申报资料的技术审评提供参考。 ……
医用无针注射器的主要性能指标都有哪些?
2024-01-12
医用无针注射器经过多年的技术发展和研究,在临床给药方面具有其独特的优势,已经逐渐成为有针给药方式的一种有益补充。从医用无针注射技术发展和产业规模增长来看,国内的医用无针注射器产业不断发展,临床应用不断普及,跟我们咨询此类产品注册的客户也日益增多。 那么,本期文章我们就结合《医用无针注射器注册审查指导原则》……
心脑电图机在使用及检定过程中的干扰及排除
2024-01-11
心脑电图机是医院普遍使用的诊断检查设备。但在使用诊断及检定过程中,心脑电图机的交流干扰是最常见的也是最棘手的问题。干扰现象的产生直接影响心脑电图机波形图的准确性,使记录器所描述的图形幅值的波形产生突变,从而直接影响到医生的诊断。 1.漏电流干扰。心脑电图诊断室内的交流电源有可能存在漏电流,这些交流电通过检定仪、地……
医用输注泵的校准方法及注意事项
2024-01-11
依据JJF1259-2018《医用注射泵和输液泵校准规范》,医用输注泵的计量性能校准项目主要包括流量和阻塞报警两部分。 一、输注泵的校准方法 1.流量 按照JJF1259-2018,在进行计量校准时采用的是体积流量输注泵,单位为mL/h。医用输注泵的流量校准采用比对法,通常使用医用注射泵和输液泵检测仪……
2023年医疗器械领域大事件
2024-01-08
1月 医疗器械监管全面调整 2023年1月1日起,《国家药监局综合司关于加强医疗器械生产经营分级监管工作的指导意见》开始施行。提出了对医疗器械生产经营企业的监管级别划分原则和检查要求,药品监管部门可以按照风险将医疗器械企业划分为四个监管级别,对不同监管级别的企业实施相应监管措施。 种植……