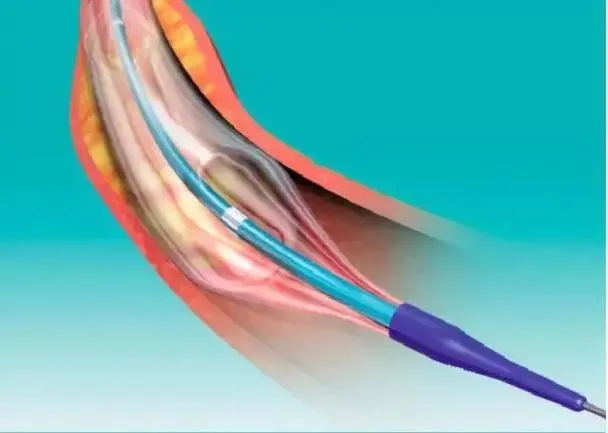
带有润滑涂层的血管介入器械研发实验要求
2023-09-07
本文适用于带有润滑涂层的血管介入器械,包括血管内导管、导丝和输送系统等。润滑涂层是指利用聚合物制备的与基材表面化学结合的涂层。润滑涂层的预期使用目的为降低介入器械与血管以及介入器械之间的摩擦力,使介入器械更好地通过迂曲血管部位。 一、带有润滑涂层的血管介入器械的性能研究实验要求 1、涂层性能研究 ……
非血管自扩张金属支架系统研发实验要求
2023-09-07
非血管自扩张金属支架系统通常由支架和输送系统组成,其中支架一般由金属材料如镍钛合金等制成,可覆高分子材料制成的膜,可带有不透射线标记。支架扩张后通过提供机械支撑作用维持或恢复腔道的通畅和/或完整性,适用于扩张食道、胆道、气道、肠道等非血管部位的腔道狭窄或重建腔道的结构和/或功能,也可适用于胆汁/胰液等的内引流。常见的非……
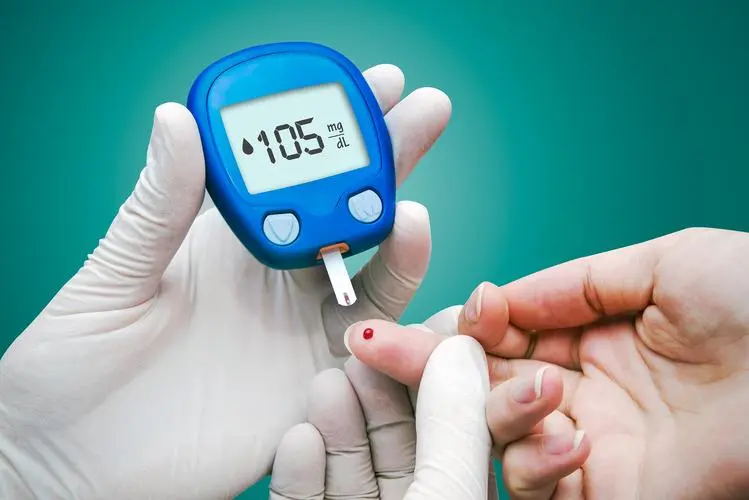
持续葡萄糖监测系统相关标准与研发实验要求
2023-09-06
本文适用于有创式持续葡萄糖监测系统。依据《医疗器械分类目录》,申报产品分类编码为07-04-03。按第三类医疗器械管理。 一、持续葡萄糖监测系统的结构组成、工作原理和产品分类 1.工作原理 持续葡萄糖监测系统的电化学反应原理,通过固定在传感器上的生物酶,如葡萄糖氧化酶,经植入到皮下组织……
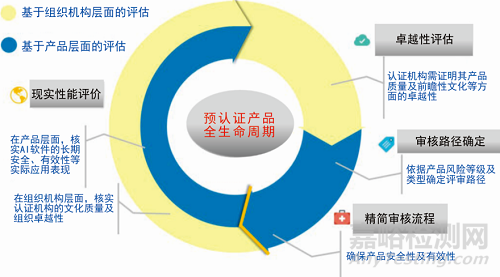
医疗人工智能技术评估与监管的国际经验及启示
2023-09-06
随着AI技术的不断发展,越来越多的AI产品被应用于医疗领域,在生物技术、医学影像识别、药物研发、辅助诊断等领域发挥了重要作用。医疗AI技术可在4个方面有效改善医疗服务:一是通过减少成本和资源浪费以及提高工作效率,来提高生产力;二是通过提高诊断的准确性和减少患者就医等待时间等,来提高服务质量;三是通过AI技术制定个性化医……
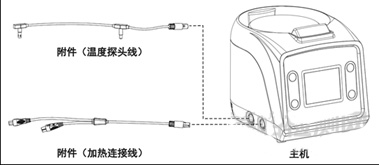
医用呼吸道湿化器研发实验要求与主要风险
2023-09-05
医用呼吸道湿化器是用于湿化输送给患者的呼吸气体的医用电气设备,通常与呼吸治疗设备配合使用,一般由主机、贮水箱和一些附件组成。当前,一些呼吸治疗设备也集成了湿化器,如睡眠呼吸暂停治疗设备、高流量呼吸治疗设备。 产品按第二类医疗器械管理,分类编码为08-05-02。 一、医用呼吸道湿化器结构组成 ……
9月开始实施的医疗器械标准清单
2023-09-04
2023年9月1日起,14项医疗器械行业标准开始实施,包括5项标准修订和9项标准制定,涉及齿科设备、外科植入物、人工智能医疗器械等多个医疗器械标准领域。 人工智能(AI)医疗器械的研发与转化进入活跃期,带动人工智能医疗器械产业发展壮大,为产品质量评价和监管带来诸多挑战。 许多产品的性能评价方法在逐步……
医疗器械无菌检验需要注意那些细节性问题?
2023-09-04
医疗器械无菌检验也就是对直接进入人体内部发生作用的制品或者要求无菌化的材料、灭菌器具等进行无菌筛查的方式,在临床预防感染和保障病人生命安全上具有重要意义。 对于单产品注射器更换的问题上,我们可以分析,注射器在包装过程中主要起注入洗脱液的作用,因此一个产品浸提液制备时,若注射器没被污染,则不需要对注射器进行……
医用分子筛制氧机研发实验要求与主要风险
2023-09-04
本文适用于采用变压吸附法(PSA)制取富氧空气(93%氧)的医用分子筛制氧机产品。在《医疗器械分类目录》中,管理编码为08-04-02,管理类别为第Ⅱ类。医用分子筛制氧机通常由单个患者使用。 一、医用分子筛制氧机结构组成与工作原理 1.结构组成 医用分子筛制氧机通常由空气压缩机、分子筛吸附塔、……
CNPPA发布《医药包装纸板选择指南》草案
2023-09-01
近日,CNPPA发布《医药包装纸板选择指南》(征求意见稿),内容如下: 医药包装纸板选择指南 Study guideline of pharmaceutical packaging paperboard ……
《电子内窥镜同品种临床评价注册审查指导原则》正式发布
2023-08-31
刚刚,GJ药品监督管理局医疗器械技术审评中心发布《电子内窥镜同品种临床评价注册审查指导原则》,内容如下: 电子内窥镜同品种临床评价注册审查指导原则 为进一步规范电子内窥镜的同品种临床评价,撰写本指导原则,旨在指导注册申请人对电子内窥镜开展同品种临床评价,同时也为技术审评部门审评电子内窥镜同品……
浅析人工智能(AI)医疗器械的注册&网络安全问题
2023-08-31
随着人工智能技术的不断发展,AI赋能类的机器人逐渐成为医疗器械行业的一颗新星。据公开报道,目前GJ药品监督管理局(NMPA)颁出的医疗AI三类证已逾20张,AI医疗影像的头部玩家更是纷纷谋求境内或境外上市。 除此,据中国电子信息产业发展研究院(CCID)发布的数据获悉,我国医疗机器人市场中,康复机器人、辅……
有源医疗器械注册检验报告常见问题
2023-08-30
对于有源医疗器械注册产品来说,有源医疗器械注册检验相对专业和复杂,且有关医疗器械注册检验报告发补项是常见事项,因此,本文为大家介绍有源医疗器械注册检验报告常见问题。 有源医疗器械注册检验报告常见问题: 当涉及有源医疗器械注册产品时,其注册检验事务相对专业且颇为复杂。由于医疗器械的特殊性,有源……