一、MDSAP是什么认证
MDSAP英文全称是Medical Device Single Audit Program。中文全称是医疗器械单一审核程序。是IMDRF 的协调项目之一。IMDRF(Intenantional Medical Device Regulator Forum, 医疗器械监管者论坛)是2012 年由美国、欧盟、澳大利亚、巴西、加拿大和日本医疗器械监管机构在原GTHF(全球医疗器械法规协调组织)基础上成立的医疗器械监管国际协调组织。我国CFDA于2013 年正式申请加入该组织。
医疗器械单一审核方案(MDSAP)允许医疗器械制造商只接受一次质量管理体系审核,即可满足五个[敏感词]的标准和法规要求。这五个[敏感词]包括澳大利亚、巴西、加拿大、日本和美国。审核由具备五国监管机构(RA)授权的审核机构(AO)进行。
检测标准
二、五国监管机构执行MDSAP声明:
1.澳大利亚:澳大利亚药品管理局(TGA)使用MDSAP的审核报告作为评估市场准入要求的一部分。可豁免上市批准要求的医疗器械,或有特殊政策要求的情况除外。
2.巴西:巴西[敏感词]卫生监督局(ANVISA)采用MDSAP审核报告和结果作为产品上市前和上市后审核的重要输入,并作为法规技术评审的支持要素。对III类和IV类的医疗器械,制造商可以用MDSAP审核去替代ANVISA的审核去获取NAVISA的GMP证书,从而获得市场准入。
3.加拿大:加拿大卫生部(HC)宣布,从2019年1月1日起,MDSAP将强制替代CMDCAS成为加拿大医疗器械准入审核方案。未在2019年1月1日前获得MDSAP证书将意味着您的医疗器械产品不能在加拿大销售。
4.美国:食品和药品管理局器械和放射健康中心(FDA CDRH)宣布,MDSAP可替代FDA的常规检查(通常两年一次)。有因检查(For Cause)、符合性后续审核(Compliance Follow-up)和上市前审批(PMA)产品除外。
5.日本:厚生劳动省(MHLW)以及医药医疗器械管理局(PMDA)对于产品上市前和上市后的审核,都可使用MDSAP报告。
其他
三、MDSAP有何优势?
1.减轻医疗器械制造商多重法规审核的负担和干扰;
2.提供可预测的审核计划(包括审核开始和结束日程);
3.有利于进入多国市场,并使广大患者受益;
4.优化监管资源配置;
5.可与ISO 13485审核相结合;
6.审核要求包括澳大利亚,巴西,加拿大,日本和美国的法规要求;
7.减少处理多重审核发现所耗用的时间和资源;
8.与多次独立审核相比,大大降低了审核成本;
9.改善行业的透明度;
四、ISO13485与MDSAP有什么关系?
1.ISO13485是MDSAP的基础;
2.MDSAP的要求要高于/多于ISO13485的要求;
3.ISO13485是标准,MDSAP除了ISO13485之外,还有各参与国的法规要求;
五、MDSAP能否完全替代参与国主管当局的审核?
对MDSAP审核结果的认可,绝不意味着主管当局放弃其监管权力。
MDSAP实施的目的在于降低各参与国主管当局的监管成本,同时降低被监管企业的管理成本.在主管当局认为有必要时,仍然可以进行审核。相关[敏感词]认可的程度如下:美国:替代FDA的常规检查(FDA专项和PMA产品除外);巴西:对于三类和四类医疗器械,可以替代ANVISA的上市前GMP检查,以及上市后的例行检查(专项检查除外);日本:对于II类,III类,IV类医疗器械,可豁免现场工厂审核;加拿大:2019年起强制取代CMDCAS,作为分类在II类及以上产品进入加拿大的[敏感词]途径;澳大利亚:可豁免TGA审核,支持颁发和保持TGA符合性审核证书。
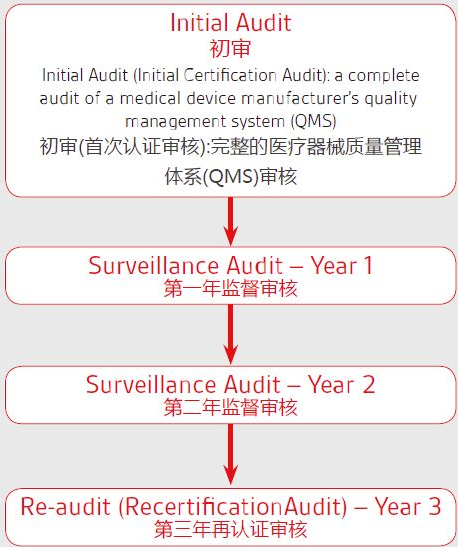
六、MDSAP认证周期:
注:
1,MDSAP的审核周期为3年;
2,特殊审核、由监管机构执行的审核以及飞行检查属于额外的审核,可能会发生在审核周期内的任一时间。